Колистин (colistin) инструкция по применению
Содержание:
- КОЛИСТИМЕТАТ НАТРИЙ:
- Особые указания
- Colistimethate — Clinical Pharmacology
- Adverse Reactions
- Особые указания
- Colistimethate Dosage and Administration
- Лекарственное взаимодействие
- Overdosage
- Indications and Usage for Colistimethate
- Фармакологическое действие
- Warnings
- Лекарственное взаимодействие
- How is Colistimethate Supplied
КОЛИСТИМЕТАТ НАТРИЙ:
Клинико-фармакологические группы
06.034 (Антибиотик для ингаляционного применения)
26.022 (Антибактериальный препарат комбинированного состава для местного применения в офтальмологии)
Фармакологическое действие
Циклический полипептидный антибиотик, образуемый Bacillus polymyxa, подвидами colistinus. Механизм действия обусловлен главным образом способностью связываться с фосфолипидами мембран бактериальных клеток, что приводит к их деструкции.
Активен в отношении большинства грамотрицательных бактерий, особенно — Pseudomonas aeruginosa и Haemophilus influenzae.
Неактивен в отношении Staphylococcus aureus, Serratia marcescens, Providencia spp., Bacteroides fragilis, Neisseria spp., облигатных анаэробов и грамположительных бактерий.
Обладает перекрестной резистентностью с полимиксином B.
Фармакокинетика
После ингаляции всасывание колистиметата натрия имеет выраженные индивидуальные различия. Cmax в плазме после ингаляции в дозе 2 млн ЕД составляет 280 мкг/л (что свидетельствует о всасывании менее 2% по сравнению с парентеральным введением). После ингаляции 2 млн ЕД колистиметата натрия средний кумулятивный показатель выведения почками — около 1%.После ингаляции 1 млн ЕД колистиметата натрия концентрация его в мокроте через 1 ч и 4 ч – 183.6 мг/л и 22.8 мг/л соответственно. В легких кумулируется около 1.5% введенной дозы.Колистиметат натрия проникает через плаценту и выделяется с грудным молоком.Колистиметат натрия выводится с отхаркиваемой мокротой. Незначительная часть препарата, попавшая в системный кровоток, выводится преимущественно путем клубочковой фильтрации. В течение 8 ч почками в неизмененном виде выводится около 60% поступившей дозы.
Дозировка
Индивидуальный, в зависимости от применяемой лекарственной формы и показаний.
Побочные действия
Возможно: аллергические реакции.
Показания
Для ингаляционного применения: инфекции дыхательных путей при муковисцидозе, вызванные Pseudomonas aeruginosa.
Для местного применения: инфекционно-воспалительные заболевания, вызванные чувствительными к данному антибиотику микроорганизмами, в т.ч. заболеваниях дыхательных путей, мочевыводящих путей, в офтальмологии, ЛОР-практике.
Противопоказания
Повышенная чувствительность к колистиметату натрия.
Особые указания
Может быть использован в составе комбинированных препаратов для местного применения в офтальмологии и ЛОР-практике.
Препараты, содержащие КОЛИСТИМЕТАТ НАТРИЙ (COLISTIMETHATE SODIUM)
• КОЛИСТИН (COLISTIN) таб.. 500 тыс.ЕД: 20 шт.• КОЛБИОЦИН (COLBIOCIN) мазь глазная 10 мг+180 тыс.МЕ+5 мг/1 г: туба 5 г• КОЛИСТИН (COLISTIN) порошок д/пригот. р-ра д/ингал. 1 млн.ЕД: фл. 1, 60 или 100 шт. в компл. с растворителем• КОЛБИОЦИН (COLBIOCIN) порошок д/пригот. глазных капель 4 мг+180 тыс.МЕ+5 мг/1 мл готового р-ра: фл. 1 шт. с крышкой-резервуаром и крышкой-капельницей
Особые указания
Ингаляционные лекарственные препараты, в т.ч. Колистин, у чувствительных пациентов могут вызывать острую бронхоконстрикцию. Поэтому применение первой дозы Колистина для ингаляций следует осуществлять под наблюдением опытного медицинского персонала, при этом ингаляции должно предшествовать применение бронхолитика, если он входит в режим терапии данного пациента. До и после ингаляции Колистина следует измерить ФОВ за 1 сек. Если у пациента, не получающего бронхолитики, имеются признаки медикаментозно обусловленной бронхиальной обструкции, при следующем применении Колистина следует повторить пробу, добавив бронхолитик.
Первое применение Колистина следует проводить под наблюдением медицинского персонала, имеющего опыт работы с пациентами, страдающими муковисцидозом.
У пациентов с нарушением функции почек следует тщательно следить за возможностью развития побочных эффектов со стороны нервной системы и регулярно контролировать функцию почек.
Между ингаляциями дорназы альфа и ингаляцией Колистина необходимо сделать перерыв.
При лечении Колистином в редких случаях возможно появление резистентных штаммов Pseudomonas aeruginosa. После отмены и/или модификации терапии возможно восстановление эффективности препарата.
В период лечения препаратом пациент должен воздерживаться от употребления алкоголя.
Влияние на способность к вождению автотранспорта и управлению механизмами
В период лечения необходимо воздерживаться от вождения автотранспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Правила использования препарата
1. Флакон с порошком вскрывают путем удаления алюминиевого колпачка с контролем первого вскрытия и открыванием резиновой пробки.
2. Ампула с растворителем вскрывается с использованием пилки или устройства для открывания ампул.
3. Содержимое ампулы полностью переливают во флакон с порошком. Порошок растворяется при легком встряхивании. Сильного взбалтывания следует избегать в связи с избыточным образованием пены.
4. Раствор переливают в небулайзер и применяют путем ингаляций согласно инструкции производителя небулайзера.
5. Процедуру ингаляции Колистина пациент выполняет в положении сидя или стоя, в нормальном спокойном состоянии, производя как можно более глубокие вдохи через мундштук небулайзера. Облегчить вдох через рот позволяет использование зажима для носа.
6. После каждого использования ингалятор следует промыть и продезинфицировать, соблюдая инструкции производителя.
У пациентов, получающих и другие виды ингаляционной терапии, ингаляционное применение Колистина следует проводить непосредственно после применения бронходилататора, а также после физиотерапевтических процедур на грудной клетке.
Colistimethate — Clinical Pharmacology
Typical serum and urine levels following a single 150 mg dose of Colistimethate for Injection, USP IM or IV in normal adult subjects are shown in Figure 1.
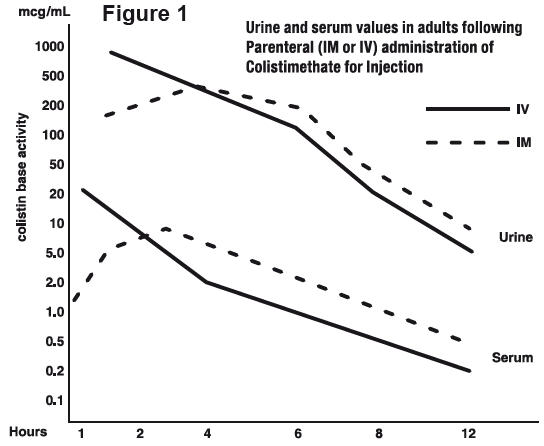
Higher serum levels were obtained at 10 minutes following IV administration. Serum concentration declined with a half-life of 2 to 3 hours following either intravenous or intramuscular administration in adults and in the pediatric population, including premature infants.
Average urine levels ranged from about 270 mcg/mL at 2 hours to about 15 mcg/mL at 8 hours after intravenous administration and from 200 to about 25 mcg/mL during a similar period following intramuscular administration.
Microbiology
Colistimethate sodium is a surface active agent which penetrates into and disrupts the bacterial cell membrane. It has been shown to have bactericidal activity against most strains of the following microorganisms, both in vitro and in clinical infections as described in the INDICATIONS AND USAGE section:
Aerobic gram-negative microorganisms:
Enterobacter aerogenes, Escherichia coli, Klebsiella pneumoniae and Pseudomonas aeruginosa.
Susceptibility Testing
For specific information regarding susceptibility test interpretive criteria and associated test methods and quality control standards recognized by FDA for Colistimethate for Injection, USP please see: https://www.fda.gov/STIC.
Adverse Reactions
The following adverse reactions have been reported:
Gastrointestinal: gastrointestinal upset
Nervous System: tingling of extremities and tongue, slurred speech, dizziness, vertigo, paresthesia and seizures
Integumentary: generalized itching, urticaria and rash
Body as a Whole: fever and anaphylaxis
Laboratory Deviations: increased blood urea nitrogen (BUN), elevated creatinine and decreased creatinine clearance
Respiratory System: respiratory distress and apnea
Renal System: nephrotoxicity and decreased urine output
For medical advice about adverse reactions contact your medical professional.
To report SUSPECTED ADVERSE REACTIONS, contact Xellia Pharmaceuticals USA, LLC at safety@xellia.com or 1-833-295-6953, or FDA at 1-800-FDA-1088 or http://www.fda.gov/medwatch/.
Особые указания
Готовить раствор из порошка следует непосредственно перед ингаляцией.
Содержимое одного флакона можно использовать только один раз, неиспользованный препарат необходимо утилизировать.
При обострении хронической инфекции, вызванной Pseudomonas aeruginosa, Колистин не должен применяться в качестве монопрепарата.
Следует учитывать вероятность развития устойчивых штаммов микроорганизмов. После отмены и/или замены Колистина возможно восстановление его эффективности.
У пациентов с повышенной чувствительностью препарат может вызвать острый бронхоспазм, поэтому введение первой дозы должно осуществляться под контролем медицинского специалиста, имеющего опыт лечения муковисцидоза. При этом ингаляцию следует делать после применения бронхолитика, если он входит в терапевтическую схему пациента. До и после ингаляции Колистина измеряют объем форсированного выдоха за первую секунду (ОФВ1). Если у больного, который не получает бронхолитик, отмечаются признаки медикаментозной бронхиальной обструкции, при следующей ингаляции Колистина пробу ОФВ1 следует повторить, добавив бронхолитик.
При порфирии стоит учитывать, что препарат может усилить ее клинические проявления.
В случае сочетанного применения с нефротоксичными средствами нужно контролировать функцию почек.
При кровохарканье колистиметат натрия может усилить кашель, поэтому его применение возможно только после оценки соотношения пользы и риска.
При одновременном применении рекомбинантной человеческой ДНазы (дорназы альфа) между ингаляциями препаратов следует делать перерыв.
Во время лечения нельзя употреблять алкогольные напитки.
Влияние на способность к управлению автотранспортом и сложными механизмами
Антибиотик Колистин может влиять на скорость реакций (например, вследствие возникновения головокружения), поэтому во время его применения рекомендуется воздержаться от управления автотранспортом и выполнения потенциально опасных видов работ, требующих быстроты психофизических реакций.
Colistimethate Dosage and Administration
Important: Colistimethate for Injection, USP is supplied in vials containing Colistimethate sodium equivalent to 150 mg colistin base activity per vial.
Reconstitution for Intravenous or Intramuscular Administration
The 150 mg vial should be reconstituted with 2 mL Sterile Water for Injection, USP. The reconstituted solution provides Colistimethate sodium at a concentration equivalent to 75 mg/mL colistin base activity.
During reconstitution swirl gently to avoid frothing.
Parenteral drug products should be inspected visually for particulate matter and discoloration prior to administration, whenever solution and container permit. If these conditions are observed, the product should not be used.
Dosage
Adults and Pediatric Patients — Intravenous or Intramuscular Administration
The dose of Colistimethate for Injection, USP should be 2.5 to 5 mg/kg per day of colistin base in 2 to 4 divided doses for patients with normal renal function, depending on the severity of the infection.
In obese individuals, dosage should be based on ideal body weight.
The daily dose and frequency should be reduced for the patients with renal impairment. Suggested modifications of dosage schedule for patients with renal impairment are presented in Table 1.
| Degree of Renal Impairment | ||||
|---|---|---|---|---|
| Normal | Mild | Moderate | Severe | |
| Creatinine Clearance (mL/min) | ≥80 | 50-79 | 30-49 | 10-29 |
| Dosage Schedule | 2.5 to 5 mg/kg, divided into 2 to 4 doses per day | 2.5 to 3.8 mg/kg, divided into 2 doses per day | 2.5 mg/kg, once daily or divided into 2 doses per day | 1.5 mg/kg every 36 hours |
Note: The suggested total daily dose is calculated from colistin base activity.
| INTRAVENOUS ADMINISTRATION |
|
| There are not sufficient data to recommend usage of Colistimethate for injection with other drugs or other than the above listed infusion solutions. |
| Administer the second half of the total daily dose by slow intravenous infusion, starting 1 to 2 hours after the initial dose, over the next 22 to 23 hours. In the presence of impaired renal function, reduce the infusion rate depending on the degree of renal impairment. |
| The choice of intravenous solution and the volume to be employed are dictated by the requirements of fluid and electrolyte management. |
| Any final intravenous infusion solution containing Colistimethate sodium should be freshly prepared and used for no longer than 24 hours. |
| INTRAMUSCULAR ADMINISTRATION |
| 1. For Intramuscular Injection, administer by deep intramuscular injection into a large muscle mass (such as the gluteal muscles or lateral part of the thigh). |
| Store reconstituted solution for intramuscular injection in a refrigerator 2° to 8°C (36° to 46°F) or between 20° to 25°C (68° to 77°F), and use within 7 days. |
Лекарственное взаимодействие
С осторожностью колистиметат натрия следует применять одновременно с потенциально нефротоксичными средствами (петлевыми диуретиками, цефалоспоринами, циклоспоринами, аминогликозидами), поскольку имеется риск усиления нефротоксичности. При применении Колистина в сочетании с аминогликозидами, миорелаксантами центрального и периферического действия, ингаляционными наркозными средствами возрастает вероятность блокады нервно-мышечной передачи
При применении Колистина в сочетании с аминогликозидами, миорелаксантами центрального и периферического действия, ингаляционными наркозными средствами возрастает вероятность блокады нервно-мышечной передачи.
Overdosage
Overdosage with Colistimethate sodium can cause neuromuscular blockade characterized by paresthesia, lethargy, confusion, dizziness, ataxia, nystagmus, disorders of speech and apnea. Respiratory muscle paralysis may lead to apnea, respiratory arrest and death. Overdosage with the drug can also cause acute renal failure, manifested as decreased urine output and increases in serum concentrations of BUN and creatinine.
As in any case of overdose, Colistimethate sodium therapy should be discontinued and general supportive measures should be utilized.
It is unknown whether Colistimethate sodium can be removed by hemodialysis or peritoneal dialysis in overdose cases.
Indications and Usage for Colistimethate
Colistimethate for Injection, USP is indicated for the treatment of acute or chronic infections due to sensitive strains of certain gram-negative bacilli. It is particularly indicated when the infection is caused by sensitive strains of Pseudomonas aeruginosa. This antibiotic is not indicated for infections due to Proteus or Neisseria. Colistimethate for Injection, USP has proven clinically effective in treatment of infections due to the following gram-negative organisms: Enterobacter aerogenes, Escherichia coli, Klebsiella pneumoniae and Pseudomonas aeruginosa.
Colistimethate for Injection, USP may be used to initiate therapy in serious infections that are suspected to be due to gram-negative organisms and in the treatment of infections due to susceptible gram-negative pathogenic bacilli.
To reduce the development of drug-resistant bacteria and maintain the effectiveness of Colistimethate for Injection, USP and other antibacterial drugs, Colistimethate for Injection, USP should be used only to treat or prevent infections that are proven or strongly suspected to be caused by susceptible bacteria. When culture and susceptibility information are available, they should be considered in selecting or modifying antibacterial therapy. In the absence of such data, local epidemiology and susceptibility patterns may contribute to the empiric selection of therapy.
Фармакологическое действие
Колистин (полимиксин Е) относится к группе полимиксинов, по химической структуре является циклическим полипептидом.
Колистин сульфат оказывает бактерицидное действие в отношении грамотрицательных бактерий, в основе которого лежит изменение структуры и нарушение функции цитоплазматической и наружной мембраны. К колистину сульфату чувствительны: Escherichia coli, отдельные виды Enterobacter spp., отдельные виды Klebsiella spp., Salmonella spp., Shigella spp., Pseudomonas aeruginosa и Haemophilus influenzae. Первично-резистентные штаммы встречаются среди Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp., Enterobacter spp.
Резистентны все виды Proteus spp., Pseudomonas caepacia, Pseudomonas maltophilia, Neisseria spp., большинство штаммов Serratia spp. и Bacteroides fragilis, а также все грамположительные бактерии. Развитие вторичной резистентности наблюдается редко. Между колистином сульфатом и полимиксином В существует полная перекрестная резистентность.
Warnings
Maximum daily dose calculated from colistin base activity should not exceed 5 mg/kg/day with normal renal function.
Transient neurological disturbances may occur. These include circumoral paresthesia or numbness, tingling or formication of the extremities, generalized pruritus, vertigo, dizziness, and slurring of speech. For these reasons, patients should be warned not to drive vehicles or use hazardous machinery while on therapy. Reduction of dosage may alleviate symptoms. Therapy need not be discontinued, but such patients should be observed with particular care.
Nephrotoxicity can occur and is probably a dose-dependent effect of Colistimethate sodium. These manifestations of nephrotoxicity are reversible following discontinuation of the antibiotic.
Overdosage can result in renal insufficiency, muscle weakness, and apnea (see section). See subsection for use concomitantly with other antibiotics and curariform drugs.
Respiratory arrest has been reported following intramuscular administration of Colistimethate sodium. Impaired renal function increases the possibility of apnea and neuromuscular blockade following administration of Colistimethate sodium. Therefore, it is important to follow recommended dosing guidelines. See section for use in renal impairment.
Clostridium difficile associated diarrhea (CDAD) has been reported with use of nearly all antibacterial agents, including Colistimethate for Injection, USP and may range in severity from mild diarrhea to fatal colitis. Treatment with antibacterial agents alters the normal flora of the colon leading to overgrowth of C. difficile.
C. difficile produces toxins A and B which contribute to the development of CDAD. Hypertoxin producing strains of C. difficile cause increased morbidity and mortality, as these infections can be refractory to antimicrobial therapy and may require colectomy. CDAD must be considered in all patients who present with diarrhea following antibiotic use. Careful medical history is necessary since CDAD has been reported to occur over two months after the administration of antibacterial agents.
If CDAD is suspected or confirmed, ongoing antibiotic use not directed against C. difficile may need to be discontinued. Appropriate fluid and electrolyte management, protein supplementation, antibiotic treatment of C. difficile, and surgical evaluation should be instituted as clinically indicated.
Лекарственное взаимодействие
При одновременном применении Колистина с ингаляционными средствами для наркоза (эфиром, галотаном), миорелаксантами или курареподобными препаратами (тубокурарином, сукцинилхолином) или аминогликозидами следует тщательно следить за возможностью развития нейротоксических реакций.
При одновременном применении Колистина с потенциально нефротоксическими препаратами (аминогликозиды, цефалоспорины, циклоспорин) возможно усиление нефротоксичности.
Фармацевтическое взаимодействие
Приготовленный раствор Колистина не следует смешивать с другими лекарственными препаратами.
How is Colistimethate Supplied
Colistimethate for Injection, USP is supplied in vials containing Colistimethate sodium (equivalent to 150 mg colistin base activity per vial) as a white to slightly yellow Iyophilized cake.
NDC-70594-023-01: one individual vial.
NDC-70594-023-02: six vials per carton.
NDC-70594-023-03: ten vials per carton.
NDC-70594-023-04: twelve vials per carton.
Store between 20° to 25°C (68° to 77°F). (See USP controlled room temperature).
Store reconstituted solution in refrigerator 2° to 8°C (36° to 46°F) or between 20° to 25°C (68° to 77°F), and use within 7 days.
Rx only
Prescribing Information as of July, 2017
Manufactured for:Xellia Pharmaceuticals USA, LLC
Buffalo Grove, IL 60089
Made in Denmark
2501-A