Триацилглицеролы — это запас энергии
Содержание:
- Заболевания, вызванные сбоем синтеза жиров
- Транспорт липидов кровью
- Обмен холестерола
- Обмен фосфолипидов
- Эйкозаноиды
- Заключительный этап биосинтеза
- Регуляция липидного обмена
- Общие сведения о липидах
- Образование жиров в человеческом организме
- Такси заказывали?
- Окисление в пищевых продуктах сенсорные и пищевые изменения
- Расщепление, переваривание и всасывание пищевых липидов
- Патологии липидного обмена
- Тиреотропный гормон
Заболевания, вызванные сбоем синтеза жиров
Нарушение липидного обмена может вести за собой следующие состояния:
- Ожирение. Возникает как при нарушении пищевых привычек, сопряженных с малоподвижным образом жизни, так и при наличии гормонального дисбаланса.
- Абеталипопротеинемия. Редкое наследственное заболевание, при котором в крови отсутствуют определенные липопротеиды. Жиры скапливаются в слизистой. Развивается деформация эритроцитов.
- Кахексия. Малое употребление калорий приводит к уменьшению жировой ткани в организме. Такое состояние может возникать при наличии опухолей, при хронических заболеваниях инфекционного характера, плохом питании или сбоях в метаболизме.
- Атеросклероз. Хроническое заболевание артерий, вызванное нарушением обмена липидов, сопряженное с отложением холестериновых бляшек на сосудистых стенках. В дальнейшем это чревато появлением склероза (разрастанием соединительной ткани), что ведет к деформации сосудов вплоть до их полной закупорки. Атеросклероз провоцирует ишемическую болезнь сердца.
- Артериосклероз Менкеберга. Данное заболевание похоже на атеросклероз. Однако его принципиальное отличие состоит в том, что сосуды деформируются и закупориваются не под влиянием соединительных тканей, а из-за кальциноза — скопления отложения солей. При таком поражении не формируются бляшки. Кроме того, болезнь провоцирует иные осложнения, главным из которых является аневризм.

Транспорт липидов кровью
Гидрофобные липиды не могут транспортироваться кровью самостоятельно. Они переносятся в следующих формах:
-
липопротеиды (липопротеины) – белково-липидные комплексы;
-
хиломикроны –липидные капли, образующиеся в млечном соке;
-
свободные жирные кислоты транспортируются в комплекте с альбуминами.
Хиломикроны –это мельчайшие капельки липида с размерами около 500 нм, плотностью 0,95 г/см3, состоящие из 2% белка и 90% ТАГ. Хиломикроны синтезируются в слизистой кишечника, считаются транспортной формой пищевых (экзогенных) липидов в организме. Хиломикроны попадают сначала в лимфу, а затем разносятся кровью в основном в жировые депо (>50%), а также в печень, лёгкие, мышечную ткань.
Липопротеиды(ЛП) являются основной транспортной формой липидов.
По электрофоретической подвижности различают: пре β – ЛП, β – ЛП, α – ЛП
По плотности выделяют:
– ЛП очень низкой плотности (ЛПОНП);
– ЛП низкой плотности (ЛПНП);
– ЛП высокой плотности (ЛПВП);
– ЛП промежуточной плотности;
– ЛП очень высокой плотности.
Все ЛП построены по общему принципу. В центре частицы находится гидрофобное ядро, в которое входят ТАГ и эфиры холестерина (Эх), вокруг него формируется гидрофильная оболочка, в которую входят фосфолипиды (ФЛ), холестерин (Х-ОН). На поверхности располагаются белки – апопротеины (АроPt).
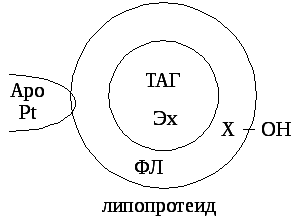
Различают несколько видов АроPt:A,B,C,E. Они формируют структуру липопротеидных частиц, взаимодействуют с тканевыми рецепторами к ЛП, являются активаторами ферментов обмена ЛП.
ЛП осуществляют транспорт липидов, жирорастворимых витаминов и гидрофобных гормонов.
Закономерности строения липопротеидов в ряду: ЛПОНП →ЛПНП→ЛПВП представлены в таблице.
Липопротеиды
|
ЛПОНП |
ЛПНП |
ЛПВП |
|
|
Размеры уменьшаются |
80 нм |
25 нм |
10 нм |
|
Плотность возрастает |
1,006 г/см3 |
1,006-1,06 г/см3 |
1,25 г/см3 |
|
% содержания белков увеличивается |
10% |
25% |
50-60% |
|
% содержания липидов уменьшается |
60% ТАГ |
45-48% холестерин |
30% холестерин 30% ФЛ |
ЛПОНП – синтезируется в печени, считаются основной транспортной формой эндогенных липидов. В эндотелии сосудов ЛПОНП и хиломикроны подвергаются действию фермента липопротеидной липазы, которая расщепляет в их составе ТАГ. В результате в составе ЛП повышается доля холестерина, и ЛПОНП превращаются в ЛПНП.
ЛПНП считаются транспортной формой холестерина от печени к органам и тканям. В тканях имеются рецепторы к ЛПНП, при участии которых происходит поглощение холестерина с последующим использованием его на построение мембран, синтез стероидов, депонированием в виде эфиров.
ЛПВП синтезируется в печени в виде дисковидных структур. Они считается транспортной формой холестерина из тканей к печени. В кровотоке при контакте с эндотелием происходит поглощение холестерина из тканей и переход его в ЛПВП. Они постепенно превращаются в сферические структуры и переносят холестерин в печень. В поглощении холестерина частицами ЛПВП участвует фермент ЛХАТ (лецитинхолестеролацилтрансфераза), который в составе ЛПВП переносит остатки жирных кислот с фосфолипидов на холестерин с образованием эфиров холестерина. Эфиры холестерина более гидрофобны по сравнению со свободным холестерином и, в силу этого, погружаются внутрь ЛП частицы.
У детейобщее содержание ЛП ниже, чем у взрослых людей. В детском возрасте снижена концентрация хиломикронов и ЛПОНП, но повышено содержание ЛПВП, в которых выше доля гидрофильных компонентов.
Содержание липидов в крови взрослых людей
|
Общие липиды |
4-8 г/л |
|
ТАГ |
1-2,5 ммоль/л |
|
ФЛ |
2,5-3,0 ммоль/л |
|
Холестерин |
3,5-5,2 ммоль/л |
|
Свободные жирные кислоты |
0,5 – 1,0 мэкв/л |
У детейсодержание общих липидов ниже, чем у взрослых. В то же время концентрация свободных жирных кислот у детей повышено примерно в два раза.
Большая часть переносимых кровью липидов откладывается в жировых депо, к которым относятся подкожно-жировая клетчатка, большой и малый сальники.У детейнаиболее активно депонирование липидов происходит в возрасте 1 года, 7 лет и в пубертатном периоде. В раннем детском возрасте у детей важным видом жировой ткани является бурая жировая ткань. Она локализована в основном на спине, на груди, имеет бурый оттенок, который обусловлен большим содержанием митохондрий иFе – содержащих цитохромов. В бурой жировой ткани происходит нефосфорилирующее окисление липидов, которое сопровождается выделением тепловой энергии (данная ткань является органом термогенеза). Жировое депо у детей легко истощается при нарушении питания, болезнях, стрессе. Липиды в жировых депо постоянно обновляются.
Обмен холестерола
Холестерол — основной стероид организма животных. У взрослого человека содержание холестерола составляет 140–150 г. Около 93% стероида входит в состав мембран и 7% находится в жидкостях организма. Холестерол увеличивает микровязкость мембран и снижает их проницаемость для Н2О и водорастворимых веществ. В крови он представлен в виде свободного холестерола, входящего в оболочку липопротеинов, и его эфиров, которые вместе с ТАГ составляют внутреннее содержимое этих частиц. Содержание холестерола и его эфиров в составе хиломикронов составляет ~ 5 %, в ЛПОНП ~10%, в ЛПНП ~ 50—60% и в ЛПВП ~ 20–30 %. Концентрация холестерола в сыворотке крови взрослого человека в норме равна ~ 200 мг/дл или 5,2 ммоль/л, что соответствует холестериновому равновесию, когда количество холестерола, поступающего в организм, равно количеству холестерола выводимому из организма. Если концентрация холестерола в крови выше нормы, то это указывает на задержку его в организме и является фактором риска развития атеросклероза.
Холестерол является предшественником всех стероидов животного организма:
- жёлчных кислот, содержание которых у взрослого человека составляет около 5 г;
- стероидных гормонов: кортикостероидов, образующихся в корковом слое надпочечников, андрогенов — в семенниках и эстрогенов — в яичниках, синтез общего количества которых не превышает 40 мг/с (с — сутки);
- витамина D3, синтезирующегося в коже под действием УФ-излучению в количестве 10 мг/с.
Холестериновое равновесие поддерживается благодаря тому, что с одной стороны холестерол поступает с пищей (~ 0,3—0,5 г/с) и синтезируется в печени или других тканях (~ 0,5 г/с), а с другой — выводится с калом в виде жёлчных кислот, холестерола желчи, продуктов катаболизма стероидных гормонов, с кожным салом, в составе мембран слущенного эпителия (~ 1,0 г/с)
Обмен фосфолипидов
Фосфолипиды выполняют ряд важных биологических функций. Как большинство полярных липидов, они являются амфифильными соединениями, несущими гидрофобные и гидрофильные группы. Некоторые фосфолипиды, например фосфатидилхолин, представляют собой диполярные ионы, обладающие катионной и анионной группами, и являются основными компонентами клеточных мембранных систем. Например, в миелиновом волокне нерва фосфолипиды и цереброзиды составляют
приблизительно 60% сухого веса.
Распределение и обмен
Среди липидов тела фосфолипиды распределены неравномерно. Богатыми источниками фосфолипидов являются липиды тканей различных желез, в особенности печени, а также плазма крови, где они могут составлять до половины всех липидов. Фосфолипиды являются также преобладающими липидами в желтках птичьих яиц и в семенах бобовых растений. Обмен различных фосфолипидов в определенных местах животного организма изучали с использованием различных изотопов, наиболее часто 32Р. Период полупревращения этих липидов колеблется от менее одного дня для фосфатидилхолина печени до более 200 сут для фосфатидилэтаноламина мозга.
Эйкозаноиды
Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, — высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как «гормоны местного действия», влияя на метаболизм продуцирующей их клетки по аутокринному механизму, и на окружающие клетки — по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус гладкомышечных клеток и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например, бронхиальной астме и аллергическим реакциям.
Субстраты для синтеза эйкозаноидов
Основным субстратом для синтеза эйкозаноидов является арахидоновая (ω-6-эйкозатетраеновая) кислота, содержащая 4 двойные связи при углеродных атомах (5, 8, 11, 14). Она может поступать с пищей или синтезироваться из линолевой кислоты. В небольших количествах для синтеза эйкозаноидов могут использоваться ω-6-эйкозатриеновая кислота с тремя двойными связями (5, 8, 11) и ω-3-эйкозапентаеновая кислота, в составе которой имеется 5 двойных связей в положениях 5, 8, 11, 14, 17. Обе минорные эйкозановые кислоты либо поступают с пищей, либо синтезируются из олеиновый и линоленовой кислот соответственно.
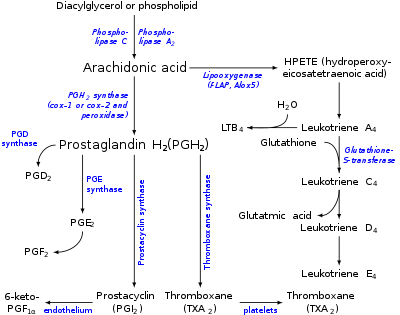
Пути биосинтеза эйкозаноидов из арахидоновой кислоты
Синтез лейкотриенов, ГЭТЕ(гидроксиэйкозатетроеноатов), липоксинов
Дополнительные сведения: Лейкотриены
Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов — гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липоксины. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ.
Липоксины (например, основной липоксин А4) включают 4 сопряжённых двойных связи и 3 гидроксильных группы.
Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4
Клинические аспекты обмена эйкозаноидов
Медленно реагирующая субстанция при анафилаксии (МРВ-А) представляет собой смесь лейкотриенов С4, D4 и Е4. Эта смесь в 100—1000 раз более эффективна, чем гистамин или простагландины как фактор, вызывающий сокращение гладкой мускулатуры бронхов. Эти лейкотриены вместе с лейкотрином В4 повышают проницаемость кровеносных сосудов и вызывают приток и активацию лейкоцитов, а также, являются важными регуляторами при многих заболеваниях, в развитии которых участвуют воспалительные процессы или быстрые аллергические реакции (например, при бронхиальной астме).
Использование производных эйкозаноидов в качестве лекарственных средств
Хотя действие всех типов эйкозаноидов до конца не изучено, имеются примеры успешного использования лекарств — аналогов эйкозаноидов для лечения различных заболеваний. Например, аналоги PG Е1 и PG Е2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы II типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2-блокаторы, ускоряют заживление язв желудка и двенадцатиперстной кишки. Способность PG Е2 и PG F2α стимулировать сокращение мускулатуры матки используют для стимуляции родовой деятельности.
Заключительный этап биосинтеза
Оказавшись в цитоплазме метаболит готов к производству прекурсора ЖК – малонил-КоА. Для этого ацетил-КоА и требуется двуокись углерода. Катализатором процесс выступает фермент ацетил-КоА-карбоксилазы. Биосинтез распределяется на два периода:
- Карбоксилирование биотин-энзима. Протекает в присутствии CO2 и АТФ.
- Перенос карбоксильной группы на метаболит.
Результирующий малонил-КоА в дальнейшем быстро трансформируется в ЖК. Процесс происходит с участием определенной ферментной системы. Фактически, это комплекс взаимосвязанных ферментов. Он именуется синтетаза жирных кислот, имеет 6 различных ферментов и связующий элемент – ацилпереносящий белок (осуществляют роль, аналогичную КоА).

Регуляция липидного обмена
В условиях положительного калорийного баланса значительная часть потенциальной энергии пищевых продуктов запасается в виде энергии гликогена или жира. Во многих тканях даже при нормальном питании, не говоря уже о состояниях калорийного дефицита или голодания, окисляются преимущественно жирные кислоты, а не глюкоза. Причина этого — необходимость сохранения глюкозы для тех тканей (например, для мозга или эритроцитов), которые постоянно в ней нуждаются. Следовательно, регуляторные механизмы, часто с участием гормонов, должны обеспечивать постоянное снабжение всех тканей подходящим топливом в условиях как нормального питания, так и голодания. Сбой в этих механизмах происходит при гормональном дисбалансе (например, в условиях недостатка инсулина при диабете), при нарушении метаболизма в период интенсивной лактации (например, при кетозе крупного рогатого скота) или из-за усиления обменных процессов при беременности (например, при токсикозе беременности у овец). Такие состояния представляют собой патологические отклонения при синдроме голодания; он наблюдается при многих заболеваниях, сопровождающихся снижением аппетита.
Общие сведения о липидах
Термин «липиды» объединяет вещества, обладающие общим физическим свойством — гидрофобностью, то есть нерастворимостью в воде. Однако такое определение в настоящее время является не совсем корректным ввиду, того, что некоторые группы (триацилглицерины, фосфолипиды, сфинголипиды и др.) проявляют себя как амфифильные или дифильные соединения, т.е. способные растворяться как в полярных веществах (гидрофильность), так и в неполярных (гидрофобность). По структуре липиды настолько разнообразны, что у них отсутствует общий признак химического строения. Липиды разделяют на классы, в которые объединяют молекулы, имеющие сходное химическое строение и общие биологические свойства.
Основную массу липидов в организме составляют жиры — триацилглицеролы, служащие формой депонирования энергии. Жиры располагаются преимущественно в подкожной жировой ткани и выполняют также функции теплоизоляционной и механической защиты.
Фосфолипиды — большой класс липидов, получивший своё название из-за остатка фосфорной кислоты, придающего им свойства амфифильности. Благодаря этому свойству фосфолипиды формируют бислойную структуру мембран, в которую погружены белки. Клетки или отделы клеток, окружённые мембранами, отличаются по составу и набору молекул от окружающей среды, поэтому химические процессы в клетке разделены и ориентированы в пространстве, что необходимо для регуляции метаболизма.
Стероиды, представленные в животном мире холестеролом и его производными, выполняют разнообразные функции. Холестерол — важный компонент мембран и регулятор свойств гидрофобного слоя. Производные холестерола (жёлчные кислоты) необходимы для переваривания жиров. Стероидные гормоны, синтезируемые из холестерола, участвуют в регуляции энергетического, водно-солевого обменов, половых функций. Кроме стероидных гормонов, многие производные липидов выполняют регуляторные функции и действуют, как и гормоны, в очень низких концентрациях. Например, тромбоцитактивирующий фактор — фосфолипид особой структуры — оказывает сильное влияние на агрегацию тромбоцитов в концентрации 10-12 М; эйкозаноиды, производные полиеновых жирных кислот, вырабатываемые почти всеми типами клеток, вызывают разнообразные биологические эффекты в концентрациях не более 10-9 М. Из приведённых примеров следует, что липиды обладают широким спектром биологических функций.
В тканях человека количество разных классов липидов существенно различается. В жировой ткани жиры составляют до 75 % сухого веса. В нервной ткани липидов содержится до 50 % сухого веса, основные из них фосфолипиды и сфингомиелины (30 %), холестерол (10 %), ганглиозиды и цереброзиды (7 %). В печени общее количество липидов в норме не превышает 10-13 %.
Нарушения обмена липидов приводят к развитию многих заболеваний, но среди людей наиболее распространены два из них — ожирение и атеросклероз.
Образование жиров в человеческом организме
Жиры являются сложными эфирами глицерина. При пищеварительном процессе они эмульгируются солями желчных кислот и входят в контакт с ферментами, при помощи которых гидролизуются. Таким образом, высвободившиеся жирные кислоты всасываются в слизистую пищеварительного тракта, что является окончанием процесса синтеза жиров. После этого жир проходит всю портальную систему организма в качестве микрочастиц, которые связываются с белками в крови. Метаболизм происходит в печени.

Синтез жиров возможен благодаря излишкам углеводов, которые не участвуют в образовании гликогена. Помимо этого, липиды получаются из некоторых аминокислот.
В сравнении с гликогеном, жиры являются компактным хранилищем энергии. При этом оно никак не ограничивается, так как имеет вид нейтральных липидов в жировых клетках. Липогенез происходит за счет синтеза жирных кислот, так как они содержатся почти во всех липидных группах.
Такси заказывали?
Транспортную роль липидов относят к второстепенной функции. Действительно, перенос веществ (преимущественно триглицеридов и холестерина) осуществляется отдельными структурами. Это связанные комплексы липидов и белков, именуемые липопротеины. Как известно, жироподобные вещества нерастворимы в воде, соответственно плазме крови. Напротив, функции белков включают гидрофильность. Как результат, ядро липопротеида – скопление триглицеридов и эфиров холестерина, тогда как оболочка – смесь молекул протеина и свободного холестерола. В таком виде, липиды доставляются к тканям или обратно в печень для вывода из организма.
Окисление в пищевых продуктах сенсорные и пищевые изменения
Из-за окисления пищевые масла, содержащие ненасыщенные жирные кислоты, вызывают серьезную озабоченность в пищевой промышленности. Деградация ненасыщенных жирных кислот путем окисления непосредственно связана с экономическими, питательными, вкусовыми, безопасными и проблемами с хранением. Существуют две основные реакции окисления, которые могут происходить в продуктах питания, содержащих липиды; Автоокисление и фотоокисление, из которых наиболее распространенным является автоокисление. Автоокисление происходит в присутствии кислорода и описывается как автокаталитическая генерация свободных радикалов. Он инициируется, когда атом водорода абсорбируется в присутствии инициаторов, таких как свет, тепло, металлы или кислород, образуя липидный радикал, который реагирует с кислородом, образуя перекисный липид-радикал. Эти пероксидные радикалы реагируют со вторым липидом, давая липидный радикал и гидроксипероксид. Реакция может быть поражена антиоксидантами, продуцирующими комбинацию радикальных видов, чтобы дать нерадикальные и нераспространяемые виды. Фотоокисление происходит, когда норма триплетного кислорода преобразуется в синглетный кислород под воздействием ультрафиолетового излучения. Синглетный кислород взаимодействует с полиненасыщенными жирными кислотами с образованием гидроксипероксида, который инициирует реакцию автоокисления.
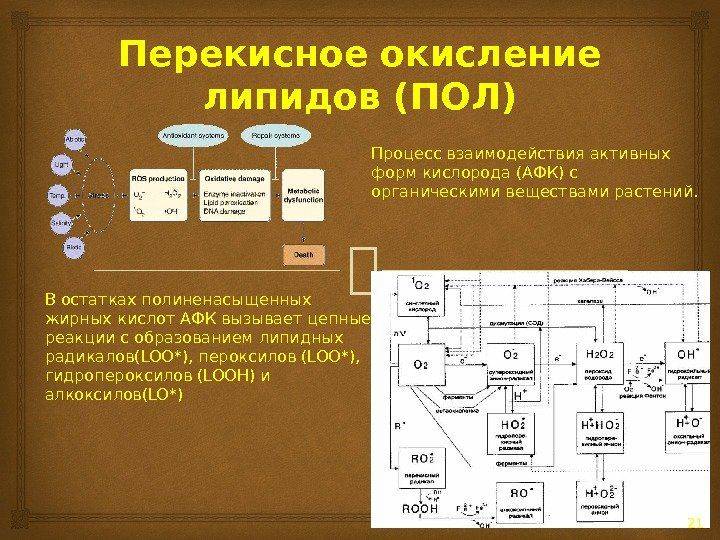
Среди этих соединений — свободные радикалы, известные как «водородные воришки», которые выделяют водород из других молекул. Это инициирует описанную выше реакцию автокаталитического окисления, приводящую к образованию продуктов первичного окисления, таких как гидроксипероксиды. Гидроксипероксиды будут разлагаться на продукты вторичного окисления с неприятным запахом и вкусом, также влияющие на внешний вид пищи. Предполагается, что вторичные продукты окисления, такие как реактивные альдегиды, спирты и кетоны, имеют отрицательные последствия для здоровья вследствие их цитотоксического, мутагенного и нейротоксического действия . Окисление липидов может также серьезно изменить пищевое качество пищевых продуктов, ухудшая состояние витаминов и полиненасыщенных жирных кислот. Перекисное окисление липидов.




Диетические ПНЖК восприимчивы к окислению как при обработке, так и при хранении. Окислительные реакции зависят от окружающей среды. Прежде всего, состав жирных кислот будет влиять на скорость окисления, так как увеличение доступных двойных связей в PUFA также означает, что есть больше участков, где может протекать реакция окисления. В целом, в пищевых продуктах также есть несколько других прооксидантов, таких как кислород и ионы металлов. Высокая температура также является фактором, который может инициировать окисление липидов
Поэтому для продуктов, содержащих ПНЖК, принимаются специальные меры предосторожности для сохранения питательного качества и продления срока годности. Один из подходов заключается в том, чтобы избегать экологических прооксидантов, таких как свет, высокая температура и кислород. Другим подходом является удаление окислительных продуктов и прооксидантов путем переработки нефтепродуктов (читайте больше в разделе «Рыбий жир и здоровье»)
Также возможно отложить перекисное окисление липидов добавлением антиоксидантов, которые сами окисляются
Другим подходом является удаление окислительных продуктов и прооксидантов путем переработки нефтепродуктов (читайте больше в разделе «Рыбий жир и здоровье»). Также возможно отложить перекисное окисление липидов добавлением антиоксидантов, которые сами окисляются.


Расщепление, переваривание и всасывание пищевых липидов
Суточная потребность человека в жирах составляет 70-80 г, хотя в пищевом рационе их содержание может колебаться от 80 до 130 г.
Переваривание липидов в желудке
В желудке имеется фермент липаза, способный катализировать расщепление триацилглицеролов. Однако оптимальной средой ее действия является среда, близкая к нейтральной. Поэтому липаза в желудке у взрослых людей практически неактивна из-за малых значений pH.
Переваривание липидов в кишечнике
В двенадцатиперстной кишке пища подвергается действию желчи и сока поджелудочной железы. На первом этапе там происходит эмульгирование жиров
Эмульгирование жиров
Жиры составляют до 90 % липидов, поступающих с пищей. Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием «липазы языка». Этот фермент синтезируется железами на дорсальной поверхности языка и относительно устойчив при кислых значениях рН желудочного сока. Поэтому он действует в течение 1-2 ч на жиры пищи в желудке. Однако вклад этой липазы в переваривание жиров у взрослых людей незначителен. Основной процесс переваривания происходит в тонкой кишке.
Так как жиры — нерастворимые в воде соединения, то они могут подвергаться действию ферментов, растворённых в воде только на границе раздела фаз вода/жир. Поэтому действию панкреатической липазы, гидролизующей жиры, предшествует эмульгирование жиров. Эмульгирование (смешивание жира с водой) происходит в тонком кишечнике под действием солей жёлчных кислот. Жёлчные кислоты представляют собой в основном конъюгированные жёлчные кислоты: таурохолевую, гликохолевую и другие кислоты.
Гормоны, активирующие переваривание жиров
При поступлении пищи в желудок, а затем в кишечник клетки слизистой оболочки тонкого кишечника начинают секретировать в кровь пептидный гормон холецистокинин (панкреозимин). Этот гормон действует на жёлчный пузырь, стимулируя его сокращение, и на экзокринные клетки поджелудочной железы, стимулируя секрецию пищеварительных ферментов, в том числе панкреатической липазы. Другие клетки слизистой оболочки тонкого кишечника в ответ на поступление из желудка кислого содержимого выделяют гормон секретин. Секретин — гормон пептидной природы, стимулирующий секрецию гидрокарбоната (НСО3-) в сок поджелудочной железы.
Нарушения переваривания и всасывания жиров
Нарушение переваривания жиров может быть следствием нескольких причин. Одна из них — нарушение секреции жёлчи из жёлчного пузыря при механическом препятствии оттоку жёлчи. Это состояние может быть результатом сужения просвета жёлчного протока камнями, образующимися в жёлчном пузыре, или сдавлением жёлчного протока опухолью, развивающейся в окружающих тканях. Уменьшение секреции жёлчи приводит к нарушению эмульгирования пищевых жиров и, следовательно, к снижению способности панкреатической липазы гидролизовать жиры.
Нарушение секреции сока поджелудочной железы и, следовательно, недостаточная секреция панкреатической липазы также приводят к снижению скорости гидролиза жиров. В обоих случаях нарушение переваривания и всасывания жиров приводит к увеличению количества жиров в фекалиях — возникает стеаторея (жирный стул). В норме содержание жиров в фекалиях составляет не более 5%. При стеаторее нарушается всасывание жирорастворимых витаминов (A, D, E, К) и незаменимых жирных кислот, поэтому при длительно текущей стеаторее развивается недостаточность этих незаменимых факторов питания с соответствующими клиническими симптомами. При нарушении переваривания жиров плохо перевариваются и вещества нелипидной природы, так как жир обволакивает частицы пищи и препятствует действию на них ферментов.
Всасывание липидов в кишечнике
Ресинтез жиров в слизистой оболочке тонкого кишечника
Основная часть всосавшихся в тонком кишечнике липидов принимает участие в ресинтезе триацилглицеринов. Для этого в эндоплазматическом ретикулуме энтероцитов работают специальные ферменты
Факторы, влияющие на всасывание липидов
Катаболизм липидов
Катаболизм липидов — совокупность всех катаболических процессов липидов, включающая несколько стадий:
- Липолиз
- Окисление жирных кислот
- Окисление кетоновых тел
- Перекисное окисление липидов
Липолиз
Липолиз — катаболический процесс, результатом которого является расщепление жиров, происходящее под действием фермента липазы.
Патологии липидного обмена
Абеталипопротеинемия
Это относительно редкое генетическое заболевание характеризуется отсутствием в плазме β-липопротеидов плотности, меньшей чем 1,063 и связано с интенсивной демиелинизацией нервных волокон. Апо-В отсутствует в плазме, так же как и в хиломикронах, ЛПОНП и ЛПНП. Уровень триацилглицеринов и холестерина плазмы очень низок. Это свидетельствует о необходимости апо-В для нормального всасывания, синтеза и транспорта триацилглицеринов и холестерина из кишечника и печени. Липиды накапливаются в клетках слизистой оболочки кишечных ворсинок, при этом наблюдается акантоцитоз — сферическая деформация эритроцитов. Более 80% эритроцитов являются акантоцитами, или, как их иначе называют, зубчатыми эритроцитами (от греч. akantha — зубец, шип).
Кахексия
Недостаточное потребление калорий может привести и к полному исчезновению жировой ткани из подкожного и сальникового депо. Это может происходить при опухолях или хроническом инфекционном заболевании, при недостаточном питании или при метаболических нарушениях, таких, как диабет или увеличение щитовидной железы. В экспериментах было показано, что повреждение определенных областей гипоталамуса вызывает анорексию даже у предварительно голодавшего животного. Для анорексии, в происхождении которой имеет значение психогенный компонент, используют термин «anorexia nervosa» (нейрогенная анорексия).
В то время как потеря липидов тела при болезни щитовидной железы связана частично с избыточной мобилизацией резервных липидов, существенной причиной кахексии при голодании, недостаточности тиамина или диабете является сниженная способность организма синтезировать жирные кислоты из углеводных предшественников.
Атеросклероз
Атеросклероз (от греч. ἀθέρος — мякина, кашица + σκληρός — твёрдый, плотный) — хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеидов в интиме сосудов. Отложения формируются в виде атероматозных бляшек. Последующее разрастание в них соединительной ткани (склероз), и кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до облитерации (закупорки)
Важно различать атеросклероз от артериосклероза Менкеберга, другой формы склеротических поражений артерий, для которой характерно отложение солей кальция в средней оболочке артерий, диффузность поражения (отсутствие бляшек), развитие аневризм (а не закупорки) сосудов. Атеросклероз сосудов ведет к развитию ишемической болезни сердца.
Тиреотропный гормон
Строение
Представляет собой гликопротеин с молекулярной массой 30 кДа, состоит из двух субъединиц α- и β, α-субъединица схожа с таковой гонадотропных гормонов, β-субъединица специфична для ТТГ.
Активируют: тиреолиберин, охлаждение (закаливание, обливание холодной водой); также усиливается в вечернее время суток.
Уменьшают: соматостатин, кортизол, тироксин и трийодтиронин (по механизму обратной отрицательной связи).
Механизм действия
Аденилатциклазный, связанный с ингибированием GI-белка и накоплением цАМФ, и кальций-фосфолипидный механизм с образованием инозитол-трифосфата, диацилглицерола и комплекса кальций-кальмодулин.
Мишени и эффекты
Тиреотропный гормон в щитовидной железе:
1. Обеспечивает жизнедеятельность щитовидной железы
- стимулирует углеводный обмен (гликолиз, ПФП), синтез гетерополисахаридов,
- повышает синтез белков, фосфолипидов и нуклеиновых кислот,
- стимулирует васкуляризацию щитовидной железы,
- стимулирует рост и пролиферацию тиреоидных клеток,
2. Стимулирует гормональную активность щитовидной железы
- активирует натрий-йодидный транспортер на базолатеральной мембране тиреоцита, что повышает захват йода,
- активирует анион-транспортный белок на апикальной мембране тиреоцита, что увеличивает переход йода в фооликулярное пространство,
- активирует все стадии образования трийодтиронина и тироксина, в том числе увеличивает экспрессию гена тиреопероксидазы.
Патология
При уменьшении выработки изменяется масса тела, повышается утомляемость, возникают симптомы гипотиреоза (см ниже).