Пцр (полимеразная цепная реакция). как производится пцр диагностика, показания, как подготовиться к исследованию, результат пцр
Содержание:
- Достоинства метода ПЦР
- Образцы для исследований
- Цены на мазок ПЦР в Москве
- Классификация используемых флуорофоров
- Способы оценки
- Методы исследования мочи на скрытые инфекции
- Преимущества и недостатки
- ПЦР исследование на ВИЧ
- Оборудование и расходные материалы для ПЦР анализа в реальном времени
- ПРИЛОЖЕНИЕ
- ПЦР мочи на бактериальные и паразитарные половые инфекции
Достоинства метода ПЦР
Высокая чувствительность исследования
Чувствительность метода такова, что амплифицировать в ПЦР и выявить целевую последовательность можно даже в том случае, если она встречается однажды в образце из 105 клеток.
Специфичность анализа
ПЦР позволяет выявлять ДНК конкретного инфекционного агента в присутствии ДНК других микроорганизмов и ДНК организма-хозяина, а также проводить генотипирование. Специфически подбирая компоненты реакции (праймеры), Вы можете одновременно выявлять ДНК близкородственных микроорганизмов.
Универсальность метода ПЦР
Дело в том, что для ПЦР-диагностики инфекционных заболеваний, либо наследственных заболеваний человека можно использовать одно и то же оборудование, следовать универсальным процедурам подготовки образцов (проб) и постановки анализа, а также однотипные наборы реактивов.
Экономия времени
Важное преимущество ПЦР – отсутствие стадий культуральной микробиологической работы. Подготовка образцов, проведение реакции и анализ результатов максимально облегчен и во многом автоматизирован
Благодаря этому, время получения результата может сокращаться до 4-5 часов.
Эффективность метода ПЦР
ПЦР помогает избежать известных сложностей, возникающих при выращивании труднокультивируемых, некультивируемых или персистирующих форм микроорганизмов для диагностики латентных и хронических инфекций. Эффективен метод ПЦР и при скрининге возбудителей с высокой антигенной изменчивостью, а также внутриклеточных паразитов.
Широта исследуемого клинического материала
В качестве образца при полимеразной цепной реакции может быть использован не только биологический материал от больного, но также и многие другие субстраты, в которых могут быть идентифицированы молекулы ДНК с высокой чувствительностью, например, вода, почва, продукты питания, микроорганизмы, смывы и многое другое.
Все перечисленные выше достоинства этого уникального метода — высокая чувствительность и специфичность, идентификация инфекционного агента и проведение генотипирования любого гена человека, высокая эффективность и экономия времени, универсальность приборной базы – позволяют широко применять сегодня метод ПЦР в клинической диагностике, медицинской практике, научных исследованиях, контроле качества и многих других областях.
Образцы для исследований
Материалом для ПЦР-анализа могут быть практически любые биологические жидкости человека. Чужеродные ДНК болезнетворных микроорганизмов способны проникать в любую среду. Чаще всего в качестве образца для исследований применяется кровь и ее отдельные компоненты (плазма или сыворотка). В жидкой ткани могут присутствовать РНК вирусного гепатита, простого герпеса, цитомегаловируса, ВИЧ.
Широкие показания к исследованию имеют биологические жидкости. К ним относятся:
- сок простаты;
- сперма;
- вагинальный секрет;
- спинномозговая (ликвор);
- амниотическая;
- бронхоальвеолярный лаваж;
- суставная жидкость;
- слюна.
Для диагностики венерических заболеваний типа гонореи, хламидиоза, микоплазмоза, уреаплазмоза, трихомониаза, гарднереллеза, герпетических форм и др., у пациентов берут эпителиальные соскобы со слизистых оболочек. У мужчин берут мазок ПЦР из уретры, а у женщин – из влагалища или шейки матки.
Отдельная категория – биоптаты. Чаще всего биоптаты исследуют с целью определения природы новообразования, подтверждения его злокачественности. Биоптаты желудка и двенадцатиперстной кишки требуются для выявления бактерии Хеликобактер пилори и ее количественной нагрузки.
Моча как биоматериал используется при инфекционных поражениях мочевыделительной системы. У мужчин мазок ПЦР нередко заменяют исследованием мочи, поскольку уретра у представителей сильного пола является универсальным элементом мочеполового тракта.
Для диагностики туберкулеза и обструктивных болезней легких исследуется мокрота. Материал могут собирать в стерильный флакон (15-20 мл) или брать мазок из зева. ПЦР-анализ также используют для выявления осложненных форм микоплазмоза и хламидиоза – при отсутствии лечения и других неблагоприятных факторов данные виды инфекции способны поражать респираторную систему человека.

Цены на мазок ПЦР в Москве
Конечная стоимость анализа будет зависеть от того, на какую инфекцию необходимо проверить пациента. В Москве на лабораторные исследования методом ПЦР установлены такие цены:
- заболевания, передающиеся половым путем – анализ выполняется в среднем за 1-2 дня, стоимость составляет 300-500 руб. (за обнаружение одного возбудителя);
- такие же сроки и цены установлены на диагностику методом ПЦР вируса Эпштейна-Барра, папилломы человека, герпеса, цитомегаловирусной инфекции;
- обследование на гепатит A, B, C, D, G обойдется пациенту в 650-800 руб., за уточнение количественной нагрузки придется заплатить еще 2000 руб. (на выполнение исследования потребуется 4-5 дней);
- подтверждение наличия в желудочном или кишечном биоптате бактерии Хеликобактер пилори (Helicobacter pylori) – 400-600 руб.;
- антитела и антигены ВИЧ— 400-500 руб.;
- количество РНК ВИЧ в образцах крови – более 10 тыс. руб.
С целью экономии врачи рекомендуют выбирать пакеты анализов – такие исследования обходятся дешевле. Услуги со скидками предоставляются в большинстве сетевых клиник, где делают анализы по методу ПЦР («СМ-Клиника», «Инвитро», «ОН-Клиник») и многопрофильных медцентрах.
Если в мазке обнаружились патогенные возбудители, не нужно отчаиваться. Главное – это как можно скорее начать терапию. Сегодня существует немало препаратов, благодаря которым даже пациенты с неизлечимыми болезнями имеют все шансы на высокое качество и нормальную продолжительность жизни. Выбор тактики лечения должен осуществлять врач. Самолечение при инфекционных заболеваниях недопустимо.
Полимеразная цепная реакция, или ПЦР, — один из наиболее точных методов молекулярно-генетической диагностики. Анализ позволяет обнаружить возбудителей болезней даже в тех случаях, когда бактериологические, иммунологические и микроскопические исследования бессильны. Специалисты с помощью ДНК-полимеразы многократно копируют чужеродный генетический материал, являющийся объектом изучения. Это позволяет получить миллион копий, в которых можно визуально зарегистрировать фрагменты или единичные клетки вирусов и бактерий. Анализ эффективен даже в сложных ситуациях, например, когда необходимо выявить возбудителя, который паразитирует внутри клетки или обладает высокой изменчивостью к антигенам.
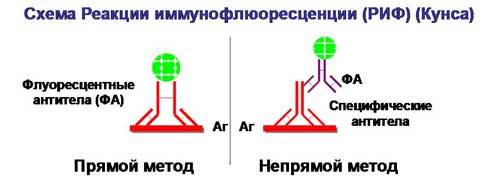
Классификация используемых флуорофоров
Специфическая детекция: флуоресцентный репортерный зонд
кПЦР с использованием флуоресцентного зонда
Флуоресцентные репортерные зонды обнаруживают только ДНК-содержащую последовательность, комплементарную зонду; следовательно, использование репортерного зонда значительно повышает специфичность и позволяет повысить точность измерения в присутствии других дцДНК. Однако флуоресцентные репортерные зонды не предотвращают ингибирующий эффект димеров праймера, которые могут подавлять накопление целевых продуктов реакции.
Можно также использовать несколько зондов, у которых флуорофоры имеют разные спектры испускания. В таком случае появляется возможность в одной пробирке детектировать сигнал от разных молекул ДНК. Метод носит название множественной ПЦР (англ. multiplex PCR).
Метод основан на введении комплементарного продукту амплификации ДНК-зонда с флуоресцентным репортером на одном конце зонда и гасителем флуоресценции на противоположном. Когда гаситель находится в непосредственной близости от репортера, он поглощает сигнал и репортер не даёт флуоресценции. Во время амплификации целостность зонда нарушается и репортер можно обнаружить по флуоресценции после возбуждения лазером. Следовательно, увеличение количества продукта, с которым связывается репортерный зонд в каждом цикле ПЦР, вызывает пропорциональное увеличение флуоресценции. Метки могут давать флуоресценцию в фазу элонгации или в фазу отжига ПЦР.
Метки, работающие в фазу элонгации:
На зонд с 5’ и 3’ концов пришиты флуорофор и его гаситель. Если последовательность зонда не очень длинная, то даже в связанном с ДНК состоянии они будут взаимодействовать друг с другом, и не будет испускаться флуоресценция. Во время элонгации ДНК-полимераза, обладающая 5’-3’-экзонуклеазной активностью (часто используется Taq-полимераза), по одному нуклеотиду диссоциирует зонд от ДНК-мишени. В результате этого процесса и флуорофор, и его гаситель попадут в раствор, где вероятность нахождения этих веществ рядом будет небольшой, и флуоресценция восстановится.
Метки, работающие в фазу отжига:
- Флуорогенная шпилька — небольшая одноцепочечная молекула ДНК, которая в свободном состоянии способна образовывать особую пространственную структуру ДНК — шпильку. На один конец цепочки пришивают флуорофор, а на второй — вещество, его гасящее. Последовательность зонда комплементарна ДНК-мишени, которую нужно детектировать. В таком случае те молекулы зонда, которые плавают в растворе, не будут давать флуоресцентный сигнал, а связавшиеся с молекулами ДНК будут претерпевать конформационные изменения, в результате которых произойдет пространственное разнесение флуорофора и его гасителя и восстановление флуоресценции. Детекцию целесообразно проводить после денатурации.
- Метка, основанная на методе FRET. Основа этого метода — наличие двух зондов, которые связываются с ДНК-мишенью на небольшом расстоянии друг от друга. На 5’-конец одного зонда и 3’-конец второго пришиты флуорофор-донор и флуорофор-акцептор соответственно. При их близком расположении происходит следующее: флуорофор-донор поглощает свет определённой длины волны и испускает свечение в более длинноволновом спектре. Эту волну, в свою очередь, поглощает флуорофор-акцептор и испускает свет, который можно детектировать.
Способы оценки
Моча при подозрениях на ИППП исследуется несколькими способами. Но оптимальный вариант для точного заключения диагноза всегда входит в непосредственную обязанность лечащего врача. Именно он обязан изучить общее состояние пациента, сделав упор на подозрения к инфекциям исходя из имеющейся симптоматики, предварительного осмотра при сборе анамнеза.
Результаты микроскопического исследования и осадка мочи при анализе могут сказать о наличии молочницы, гонореи и трихомонадной инфекции. Данный способ информативен благодаря тому, что моча успев пройти через мочеиспускательный канал может иметь в наличии примеси лейкоцитов и возбудителей.
В некоторых случаях методика микроскопии бывает не всегда целесообразна при выявлении скрытых инфекций. Стоит знать, что урина является нестерильной жидкостью, имея при этом большое число бактерий. Именно поэтому дифференциация под микроскопом зачастую не дает желаемых результатов.
Посев
Анализ мочи на посев – один из общепринятых показателей биологического материала при выявлении скрытых инфекций. Исследуют урину следующим образом.
С помощью стерильных инструментов полученная урина переносится на питательную среду. Имеющиеся бактерии в данной среде получают возможность увеличиваться в размерах и размножаться, образуя при этом большие колонии. Все это дает возможность более точно провести исследования появившихся патогенных образований и определиться с диагнозом инфекции.
Важно иметь в виду, что для разных бактерий применяются различные культурные среды. Необходимо точно угадать, в какой среде и при каком температурном режиме микроорганизмы смогут полноценно жить и размножаться
Для точного определения температурного режима врачами используется прибор термостат.
Методика посева дает возможность обнаружить наличие различных бактерий и грибков. Однако, далеко не все вирусные инфекции поддаются данной диагностике. Дорогостоящее оборудование уже говорит о нецелесообразности выявления сложных вирусов посредством данного анализа.
ПЦР и серология
Анализ мочи методом ПЦР при выявлении ИППП является альтернативным вариантом, заменяя стандартный посев.
ПЦР-диагностика – современный и более точный способ выявления большинства инфекционных заболеваний с минимальным риском погрешностей, где человеческий фактор не влияет на результаты исследования. Взяв мочу на исследование, можно обнаружить ДНК-фрагменты, имеющие непосредственную принадлежность к инфекционному возбудителю.

Резонный вопрос, какие ЗППП можно выявить, используя в арсенале исследований ПЦР мочи? Диагностируются практически все инфекции за исключением вируса ВПЧ, который затруднительно обнаружить в моче даже посредством такой высокоточной методики.
Что пациентам предлагается взамен ПЦР? Альтернативный способ исследований – различные методы серологической диагностики. Иммуноферментный анализ (ИФА) – один из вариантов выявления в организме антител к различным возбудителям. В данном случае целесообразно использовать не столько мочу, сколько кровь из вены.
Методы исследования мочи на скрытые инфекции
Исследование урины для выявления заболевания выполняют, если необходимо диагностировать скрытые инфекции, спровоцировавшие воспалительный процесс в мочеиспускательном канале.
Существует несколько разных способов определения ЗППП в биоматериале.
Важно учесть, что способ микроскопического анализа, в данном случае, неприемлем. Моча может содержать множество видов микроорганизмов и провести их дифференциацию при рассматривании в микроскоп является очень сложной задачей
Моча может содержать множество видов микроорганизмов и провести их дифференциацию при рассматривании в микроскоп является очень сложной задачей.
Для определения ИППП в организме по моче, чаще всего, применяются следующие методики:
- ПЦР. Диагностика возможна только если в образце будут присутствовать в большом количестве эпителиальные клетки. Методика определения возбудителя основана на наличии в образце, взятом для анализа, генетического материала патогена. ПЦР-диагностика является очень точной методикой, практически лишенной погрешностей.
- ИФА – это методика, которая позволяет в крови больного человека обнаружить антитела к возбудителям заболеваний. Но, моча не может служить биоматериалом, для обнаружения иммуноглобулинов.
- Посев мочи – наиболее простой вариант исследования образца на скрытые инфекции. Принцип исследования заключается в том, что биоматериал в стерильных условиях переносится на питательную среду, где возбудитель чувствует себя очень комфортно и поэтому начинает размножаться.
В результате образуются крупные колонии.
Таким образом, становится возможной идентификация патогена.
С помощью посева можно обнаружить бактериальных и грибковых возбудителей.
Диагностировать вирусную инфекцию с помощью культурального посева не представляется возможным.
Для определения вирусной инфекции применяются другие методики.
Помимо диагностики, доктор может проверить патогенов на чувствительность к различным антибиотикам и, таким образом, подобрать наиболее эффективное лечение.
Преимущества и недостатки
За широкий перечень преимуществ автор методики получил Нобелевскую премию, как подтверждение признания специалистов универсальности и высоких возможностей такого способа диагностики.
К неоспоримым достоинствам ПЦР можно отнести следующие:
- Очень высокая чувствительность. Обычно говорят о чувствительности от 95 до 100%, но это усредненные данные. Этот показатель отличается для разных микроорганизмов. Так, для гепатита С он не бывает ниже 97% (при условии выполнения всех требований), а для определения уреаплазмоза — не менее 99%. Такая чувствительность является самой высокой на данный момент, поэтому способ почти не имеет конкурентов по этой характеристике.
- Возможность применения на самых ранних стадиях. В то время, когда другие методы диагностики еще не способны выявить возбудителя из-за его малого количества в образце пробы, ПЦР уже выдает корректный результат. Обнаружить присутствие возбудителя можно даже при наличии единственного экземпляра, а в некоторых случаях — только фрагмента микроба. По этой причине способ применяется и при хронических или скрытых течениях патологий, а также в стадии инкубации.
- Широкий спектр результатов. Анализ способен выявить одновременно несколько возбудителей, для этого не понадобится проводить повторные манипуляции. Иногда удается найти возбудителей, которые даже не предполагались при первичной диагностике.
- Универсальность образцов. В качестве пробы могут быть представлены образцы крови, слюны, мокроты, волосы, выделения из влагалища, клетки разных тканей.
- Скорость получения результатов. В большинстве случаев ответ получают через 5-6 часов. Для культурального анализа, приближающегося к полимеразной цепной реакции в плане точности, такой же результат можно получить в срок от нескольких дней до пары недель.
- Количественное определение возбудителя. Этот параметр позволяет определять титр микробов в материале, а это свойство часто необходимо для оценки эффективности выбранной тактики лечения.
- Выявление самого микроорганизма, а не определение его реакций. Большинство анализов основаны на ответной реакции возбудителя на химические реактивы, окрашивание и т. д. Этот способ диагностики позволяет обнаруживать непосредственно микроб, а не косвенные признаки, антитела и т. п.
Несмотря на такой широкий перечень преимуществ, у метода есть и некоторые недостатки:
- Из-за загрязнения пробы предыдущим образцом может произойти ложное выявление микроорганизмов. Такое происходит при загрязнении инструментов или реактивов, участвующих в ходе анализа. Даже в воздухе присутствуют фрагменты микробов, способных отразится на результате, поэтому в таких лабораториях обязательно должен быть установлен биологический фильтр с максимальной степенью очистки воздуха.
- Ложноотрицательный результат. Даже при всех явных проявлениях болезни иногда получают отрицательные данные. Причина этого – в неверно выбранном месте для взятия образца, поэтому персонал лаборатории должен обладать достаточной квалификацией, знаниями и опытом.
- Оценка данных должна производиться исключительно лечащим врачом, потому что интерпретация результатов ПЦР-анализа — сложный процесс. Наличие положительного ответа не всегда означает болезнь. Дело в том, что после того, как заболевание успешно пролечено, фрагменты возбудителя долго присутствуют в крови, поэтому заключение может сделать только очень квалифицированный специалист.
- Высокая стоимость диагностики с применением полимеразной цепной реакции. Цена обусловлена дорогостоящим оборудованием и высокими требованиями к условиям лабораторий и квалификации персонала.
Обязательные условия для получения точных данных в ПЦР-лабораториях:
- корректный механизм забора проб и их правильная транспортировка в лабораторию;
- точное соблюдение методик в ходе выполнения анализа;
- высокая стерильность и максимальная автоматизация процесса;
- использование одноразовых инструментов;
- система внутрилабораторного контроля для подтверждения достоверности данных.
При условии выдерживания всех требований на основе данных, полученных при помощи методики ПЦР, можно не только определить болезнь, но сделать прогноз ее течения и составить алгоритм лечения.
ПЦР исследование на ВИЧ
ПЦР на ВИЧ следует выделить отдельным пунктом, так как тут существует специфический набор ограничений.
Во-первых, ПЦР на ВИЧ определяет не ДНК вируса иммунодефицита человека, а ДНК измененной вирусом клетки-лимфоцита. В нем будет храниться информация о вирусе и размножаться, создавая все больше пораженных лимфоцитов.
При исследовании ПЦР на ВИЧ вероятность ложноположительного результата составляет около 2%, если не было нарушений среди медицинского персонала (правильно маркированная пробирка, не перепутали пробирки местами, не было загрязнения материала при вскрытии пробирки).
Длительность ПЦР может составлять от 4 часов до 7 суток, в зависимости от организованности медицинского учреждения, где происходит диагностика инфекций.
Оборудование и расходные материалы для ПЦР анализа в реальном времени
| Амплификатор в режиме реального времени Mx3005P | Амплификатор в режиме реального времени Mx3000P | Амплификатор в режимереального времени TOptical |
| Термоциклер для ПЦР в реальном времени PikoReal | Система ПЦР в реальном времени Applied Biosystems 7500 | Амплификатор в режиме реального времени АНК-32-М |
 Экспресс-амплификатор в режиме реального времени АНК-4 Экспресс-амплификатор в режиме реального времени АНК-4
|
Реагенты для ПЦР | Системы для выделения и очистки нуклеиновых кислот |
| Лабораторный пластик и посуда | Автоматические пипетки | Центрифуги и вортексы |
| Амплификатор для ПЦР в реальном времени Smart Cycler II | ПЦР боксы для стерильных работ | Термоблоки |
Существует два основных подхода к детекции результатов ПЦР в реальном времени: с помощью интеркалирующих красителей и на основе флуоресцентно-меченых олигонуклеотидных зондов.
Низкоспецифичная детекция результатов ПЦР-РВ с помощью интеркалирующих красителей
Детекция продуктов амплификации возможна за счет увеличения флуоресценции интеркалирующего красителя при образовании комплекса с двуцепочечной ДНК. Самый популярный краситель на сегодняшний день — SYBR Green I. Это чувствительный флуоресцентный индикатор двухцепочечной ДНК. Максимум флуоресценции в комплексе с ДНК составляет 521 нм, максимум возбуждения — 497 нм (второй максимум около 254 нм). Хорошо возбуждается стандартным 488-нм лазером. Квантовый выход флуоресценции — около 0.8 (что в 5 раз превышает квантовый выход комплекса этидий-ДНК).
Реже применяются красители EVA Green, LCGreen, Cyto9. Низкая специфичность детекции результатов ПЦР-РВ при использовании интеркалирующих красителей обусловлена тем, что флуореценция раствора вызывается накоплением любой двуцепочечной ДНК в реакционной смеси, в том числе и неспецифической! Следовательно, остается вероятность регистрации ложноположительного результата.
Как работает ПЦР в реальном времени c использованием специфичных зондов?
Более высокой специфичности детекции результатов ПЦР в режиме реального времени можно достигнуть за счет наличия в реакционной смеси дополнительного олигонуклеотида — гибридизационного зонда. Такой зонд «отжигается» (комплементарно соединяется с ДНК) на участке ампликона меджу прямым и обратным праймером. На разных концах зонда расположены флуорофор и тушитель флуоресценции этого красителя. Когда флуорофор и тушитель связаны с олигонуклеотидным зондом, наблюдается лишь незначительная флуоресцентная эмиссия. Во время процесса амплификации за счет 5`-экзонуклеазной активности Taq-полимеразы флуоресцентная метка переходит в раствор, освобождаясь от соседства с тушителем и генерирует флуоресцентный сигнал, усиливающийся в реальном времени пропорционально накоплению амплификата.
Таким образом, в случае если используемые праймеры «отожгутся» на неспецифических участках с образованием в ходе ПЦР-РВ «нецелевого» продукта, то его последовательность не будет иметь участок, комплементарный гибридизационному зонду и, соответственно, «нецелевые» ампликоны не будут регистрироваться как целевые. При этом для такого варианта ПЦР-РВ можно одновременно использовать несколько видов красителей и гасителей их флуоресценции (с неперекрывающими спектрами излучения). Это позволяет осуществлять мультиплексную ПЦР.
ПРИЛОЖЕНИЕ
Кривая амплификацииКривая амплификации показывает зависимость флуоресценции репортерного красителя от номера цикла. Реакции различаются по времени, когда возможно обнаружить продукты амплификации. Чем больше изначальное количество ДНК-матриц в исследуемом образце, тем раньше возникнет достаточная для детекции флуоресценция.
Базовая линияВо время начальных циклов реакции наблюдаются фоновые флуоресцентные сигналы. В соответствие с этим фоном необходимо настроить значение базовой линии.
Дельта RnЗначение ΔRn представляет собой разницу значений Rn и базовой линии.
Референтный красительКраситель, который создает внутреннюю референтную флуоресценцию, по отношению к которой можно нормализировать репортерную флуоресценцию. Нормализация необходима для того, чтобы скорректировать флуктуации, связанные с различиями концентраций компонентов реакционной смеси, объема и особенностей образца.
Эффективность ПЦРСледующая формула описываю прохождение ПЦР:Cn=Ci*(1+E)n , гдеCi – начальное количество ДНК-матрицы,Cn – количество ампликонов на цикле n,n – количество циклов,E – эффективность данной реакции.Если эффективность максимальная (=1), тогда формула приобретет вид Cn=Ci*2n, при этом количество продуктов реакции (ампликонов) будет увеличиваться в 2 раза с каждым циклом. Если эффективность ниже, то каждый цикл ампликоны будут синтезироваться в меньшем количестве, что отобразиться на кривой амплификации. Оптимальная эффективность – от 90 до 110%.
Репортерный красительРепортерный краситель связан с 5’-концом зонда TaqMan. При гибридизации зонда с ДНК-матрицей, этот краситель дает флуоресцентный сигнал, сигнализирующий об успешной гибридизации. Если используется краситель SYBR Green , то сигнал последует при интеркалляции красителя в двухцепочечеую ДНК, что свидетельствует об успешной амплификации. Специфичность связывания с целевой последовательностью ДНК необходимо проверить по кривой плавления продуктов реакции, либо на гель-электрофорезе.
RnЗначение Rn представляет собой отношение интенсивности флуоресценции репортерного красителя к интенсивности флуоресценции референтного красителя.
Пороговое значение (пороговая линия, порог чувствительности)Это значение ΔRn для CT в данном виде анализа. Порог чувствительности настраивается таким образом, чтобы он был выше базовой линии, но при этом кривая амплификации должна пересекать его в самом начале экспоненциальной фазы.
Пороговый цикл (CT)Цикл, во время которого кривая амплификации пересекает пороговое значение.
ПЦР мочи на бактериальные и паразитарные половые инфекции
Проникновение в организм бактерий и простейших паразитов становится причиной развития болезней урогенитального тракта — уретрита, цистита. Мужчинам ИППП угрожают развитием бесплодия, присоединением простатита. У женщин половые инфекции провоцируют воспалительные заболевания влагалища (кольпит), канала шейки матки (цервицит), большой железы преддверия влагалища (бартолинит), внутреннего слоя матки (эндометрит), яичников и маточных труб (сальпингоофорит).
Классификация заболеваний по возбудителю
| Патогенный микроорганизм | Заболевание |
|---|---|
| Бактериальные инфекции | |
| микоплазма | микоплазмоз |
| гарднереллы | гарднереллез |
| гонококки | гонорея |
| уреаплазма | уреаплазмоз |
| хламидии | хламидиоз |
| бледная трепонема (спирохета) | сифилис |
| Инвазии простейших паразитов | |
| трихомонада | трихомониаз |
ПЦР мочи на обнаружение бледной трепонемы проводят редко. Трепонемные и нетрепонемные тесты на сифилис, выполненные по пробе крови, более информативны.
Прямое показание к исследованию на ИППП — появление характерной симптоматики:
- поллакиурия (частое опорожнение мочевого пузыря), сопровождающаяся ощущениями жжения и рези;
- зудящие высыпания, эрозии, язвочки в зоне гениталий;
- боли в нижней части живота с иррадиацией в зону поясницы;
- длительная субфебрильная температура тела (37–38 С);
- диспареуния (болезненные ощущения во время интимной близости и после секса);
- слизистые выделения из уретры у мужчин;
- лейкоррея у женщин (неспецифические влагалищные выделения с неприятным запахом).
Дополнительный женский признак инфицирования — НМЦ (нарушение менструального цикла).
ЗППП бактериальной и паразитарной этиологии могут протекать бессимптомно. С момента инфицирования до обнаружения возбудителя проходит много времени, за которое носитель инфекции заражает половых партнеров. Полимеразная цепная реакция выявляет возбудителей на любом этапе болезни при отсутствии выраженных проявлений.
Дополнительно
При подозрении на инфицирование палочкой Коха анализ ПЦР мочи на туберкулез мочеполовой системы позволяет диагностировать патологию за сутки. Для сравнения, постановка диагноза методом бактериологического посева осуществляется за месяц, в течение которого туберкулез продолжает прогрессировать, разрушая организм.