12 методов в картинках: полимеразная цепная реакция
Содержание:
- Проведение ПЦР
- Примечания
- Проведение ПЦР
- Амплификация ДНК
- Подготовка образцов
- Примечания[править | править код]
- Проведение анализа
- Цена на проведение процедуры
- ПЦР-диагностика внутриутробных инфекций
- Классификация используемых флуорофоров[править | править код]
- Какие преимущества имеет данная диагностика?
- Ход анализа полимеразной цепной реакции
- Примечания
Проведение ПЦР
Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований.
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
- Два , противоположным концам разных цепей требуемого фрагмента ДНК.
- Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза), Thermus thermophilus (Tth-полимераза) и другие.
- Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
- Ионы Mg2+, необходимые для работы полимеразы.
- Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦР-реакции. Этот фермент катализирует гидролиз пирофосфата, побочного продукта присоединения нуклеотидтрифосфатов к растущей цепи ДНК, до ортофосфата. Пирофосфат может ингибировать ПЦР.
Праймеры
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см. ).
Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер-матрица.
Tm — температура, при которой половина ДНК-матриц образует комплекс с олигонуклеотидным праймером. Усредненная формула подсчета Tm для короткого олигонуклеотида (и для длинных фрагментов ДНК), с учётом концентрации ионов K+ и DMSO:
Tm=77,1+11,7lgK++41(G+C)−528L−,75%DMSO{\displaystyle T_{m}=77,1+11,7\lg+{\frac {41(G+C)-528}{L}}-0,75},
где L — количество нуклеотидов в праймере, K+ — молярная концентрация ионов калия, G+C — сумма всех гуанинов и цитозинов.
В случае неверного выбора длины и нуклеотидного состава праймера или температуры отжига возможно образование частично комплементарных комплексов с другими участками матричной ДНК, что может привести к появлению неспецифических продуктов. Верхний предел температуры плавления ограничен оптимумом температуры действия полимеразы, активность которой падает при температурах выше 80 °C.
При выборе праймеров желательно придерживаться следующих критериев:
- GC-состав ~ 40—60 %;
- близкие Tm праймеров (отличия не более, чем на 5 °C);
- отсутствие неспецифических вторичных структур — шпилек и димеров;
- желательно, чтобы на 3’-конце был гуанин или цитозин, поскольку они образуют три водородные связи с молекулой матрицы, делая гибридизацию более стабильной.

Амплификатор
Основная статья: Амплификатор
Амплификатор для проведения ПЦР
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Примечания
- ↑
- ↑
- Life Technologies (Thermo Fisher Scientific). Real-time PCR handbook / Life Technologies (Thermo Fisher Scientific). — Life Technologies (Thermo Fisher Scientific). — 2014. — С. 40—43. — 68 с.
- ↑
- Sails AD (2009). «Applications in Clinical Microbiology». Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4
- FDA Authorizes Emergency Use of Influenza Medicines, Diagnostic Test in Response to Swine Flu Outbreak in Humans. FDA News, April 27, 2009.
- Filion, M (editor) (2012). Quantitative Real-time PCR in Applied Microbiology.Caister Academic Press. ISBN 978-1-908230-01-0.
Проведение ПЦР
Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований.
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
- Два , противоположным концам разных цепей требуемого фрагмента ДНК.
- Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза), Thermus thermophilus (Tth-полимераза) и другие.
- Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
- Ионы Mg2+, необходимые для работы полимеразы.
- Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦР-реакции. Этот фермент катализирует гидролиз пирофосфата, побочного продукта присоединения нуклеотидтрифосфатов к растущей цепи ДНК, до ортофосфата. Пирофосфат может ингибировать ПЦР-реакцию.
Праймеры
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см. ).
Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер-матрица.
Tm — температура, при которой половина ДНК-матриц образует комплекс с олигонуклеотидным праймером. Усредненная формула подсчета Tm для короткого олигонуклеотида (и для длинных фрагментов ДНК), с учётом концентрации ионов K+ и DMSO:
Tm=77,1+11,7lgK++41(G+C)−528L−,75%DMSO{\displaystyle T_{m}=77,1+11,7\lg+{\frac {41(G+C)-528}{L}}-0,75},
где L — количество нуклеотидов в праймере, K+ — молярная концентрация ионов калия, G+C — сумма всех гуанинов и цитозинов.
В случае неверного выбора длины и нуклеотидного состава праймера или температуры отжига возможно образование частично комплементарных комплексов с другими участками матричной ДНК, что может привести к появлению неспецифических продуктов. Верхний предел температуры плавления ограничен оптимумом температуры действия полимеразы, активность которой падает при температурах выше 80 °C.
При выборе праймеров желательно придерживаться следующих критериев:
- GC-состав ~ 40—60 %;
- близкие Tm праймеров (отличия не более, чем на 5 °C);
- отсутствие неспецифических вторичных структур — шпилек и димеров;
- желательно, чтобы на 3’-конце был гуанин или цитозин, поскольку они образуют три водородные связи с молекулой матрицы, делая гибридизацию более стабильной.

Амплификатор
Амплификатор для проведения ПЦР
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Амплификация ДНК
Для осуществления следующего этапа ДНК-диагностики — амплификации ДНК — врачи используют так называемые ДНК-матрицы — молекулы ДНК инфекций, на которые впоследствии будет происходить «клонирование» ДНК. Уже упоминалось, что наличие полной ДНК инфекции необязательно, для проведения этого этапа достаточно небольшого кусочка молекулы ДНК, который присущ только данному микробу (инфекции).
В основе амплификации ДНК и соответственно в основе всего принципа ПЦР-реакции лежит естественный для всего живого процесс достраивания ДНК — репликации ДНК, который осуществляется путем удвоения единичной цепочки ДНК.
Начав с одного-единственного фрагмента ДНК, врач-лаборант копирует его и увеличивает количество копий в режиме цепной реакции: после первого цикла у вас уже есть 2 фрагмента, после второго цикла — 4, после третьего — 8, после четвертого — 16, затем 32, 64, 128, 256… С каждым циклом происходит удвоение числа копий, и после двадцати циклов счет уже идет на миллионы, а после тридцати — на миллиарды. Цикл длится считанные минуты и сводится к определенному изменению температурного режима в очень небольшом химическом реакторе. Здесь в растворе в достаточном количестве находятся все нужные компоненты синтеза, прежде всего, нуклеотиды А, Г, Т и Ц, а также проведены тонкие подготовительные химические операции для того, чтобы с каждого готового отрезка ДНК тут же снималась точная копия, затем с этой копии — снова копия, в этом и состоит разветвленная цепная реакция.
Путем присоединения к цепи ДНК праймеров — искусственно синтезированных «кусочков» ДНК (нуклеотидных пар), аналогичных ДНК микробов (инфекции) — образуются две короткие, состоящие из двух цепей участков ДНК, спирали, необходимые для синтеза будущей ДНК.
Синтез новой цепи происходит путем достраивания каждой из двух нитей ДНК. Процесс амплификации происходит с помощью специфического участка — ДНК-полимеразы, давшему название лабораторному методу. Полимераза выступает в роли катализатора реакции и следит за последовательным прикреплением нуклеотидных оснований к растущей новой цепи ДНК.
Таким образом, амплификация ДНК представляет собой многократное увеличение числа копий ДНК, которые специфичны, т. е. присущи только определенному организму. Нет необходимости достраивать всю цепь ДНК, чтобы увидеть возбудителя инфекции. Нужен только тот участок, который характерен для данной бактерии как для индивидуальности.
Все многочисленно повторяющиеся этапы амплификации происходят при различных температурах. Для проведения ПЦР-анализа используется специально программируемое оборудование — ПЦР — термостат или амплификатор, которое автоматически осуществляет смену температур. Амплификация проводится по заданной программе, соответствующей виду определяемой инфекции. В зависимости от программы и вида определяемой инфекции процесс автоматизированной ПЦР занимает от 2 до 3 часов.
Важное значение в ПЦР-диагностике играет квалификация врача-лаборанта, проводящего анализ, от него зависит правильность настройки ПЦР-оборудования и интерпретация полученных результатов. Врачи медицинского центра «Евромедпрестиж» имеют большой опыт в проведении ДНК-диагностики, что обеспечивает достоверность полученных результатов исследования и гарантирует положительный успех в лечении инфекционных заболеваний
Чтобы сдать анализы методом ПЦР и провести полную диагностику и лечение инфекционных заболеваний в нашем медицинском центре «Евромедпрестиж».
Подготовка образцов
Целью подготовки образцов является
- исключение ПЦР-ингибиторных веществ, которые могут уменьшить способность к амплификации ДНК и эффективность амплификации;
- увеличение концентрации целевых организмов до практического рабочего диапазона данной ПЦР методики;
- уменьшение количества гетерогенных объемных образцов и получение гомогенных образцов для амплификации с целью обеспечения воспроизводимости и повторяемости теста.
Все эти факторы влияют на выбор метода подготовки пробы. Однако, многие методы подготовки проб являются трудоемкими, дорогостоящими и требующими много времени или же не удовлетворяют критериям необходимого качества матрицы. Поскольку подготовка проб является сложным шагом в диагностической ПЦР, было разработано большое разнообразие методов и все эти методы влияют на ПЦР анализ по-разному с точки зрения специфичности и чувствительности. Самые часто используемые методы подготовки проб можно разделить на четыре разные категории:
- биохимические;
- имунологические;
- физические;
- физиологические методы.
Список некоторых веществ, которые могут негативно повлиять на эффективность ПЦР, показан в Таблице 1.
Таблица 1. Методы подготовки образцов используемые для различных видов проб
| Категория метода подготовки образца | Подкатегория | Метод подготовки образца | Образец |
| Биохимические | Адсорбция | Разделение на основе лектина | Мясо говядины |
| Адсорбция белка | Кровь | ||
| Экстракция ДНК | Метод очистки ДНК | Гемолитическая сыворотка | |
| Литические методы | Антикоагулянты крови | ||
| Иммунологические | Адсорбция | Иммуногенетический захват | Кровь |
| Физические | Водные двухфазные системы | Мягкий сыр | |
| Центрифугирование в растворе с градиентом плавучей плотности | Фарш | ||
| Центрифугирование | Моча | ||
| Растворение | Кровь | ||
| Фильтрация | Молоко | ||
| Физиологические | Обогащение | Мясо |
Примечания[править | править код]
- ↑
- ↑
- Life Technologies (Thermo Fisher Scientific). Real-time PCR handbook / Life Technologies (Thermo Fisher Scientific). — Life Technologies (Thermo Fisher Scientific). — 2014. — С. 40—43. — 68 с.
- ↑
- Sails AD (2009). «Applications in Clinical Microbiology». Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4
- FDA Authorizes Emergency Use of Influenza Medicines, Diagnostic Test in Response to Swine Flu Outbreak in Humans. FDA News, April 27, 2009.
- Filion, M (editor) (2012). Quantitative Real-time PCR in Applied Microbiology.Caister Academic Press. ISBN 978-1-908230-01-0.
Проведение анализа
Весь процесс осуществляется в несколько основных этапов:
- Сбор материала. Его осуществляют в процедурном кабинете конкретного профиля. Инструменты и посуда должны быть стерильными.
- Хранение и доставка биологического материала. При температуре около 20 градусов держать пробу можно не более двух часов. В охлаждённом состоянии материал допускается хранить одни сутки. Пробу можно заморозить на срок до двух недель. Если требуется транспортировка, осуществлять её необходимо при использовании термоконтейнеров.
- Выделение ДНК. Проводится разными способами в зависимости от вида имеющегося материала и исследуемых микроорганизмов.
- ПЦР. Немного материала переносят в специальную ёмкость, добавляют амплификационную смесь. Этот сосуд устанавливают внутрь программируемого прибора, где происходит автоматическое удвоение ДНК. Процесс может длиться до 3 часов. Параллельно с этим проводят ещё два исследования — положительное (содержит исследуемое ДНК) и отрицательное.
- Регистрация полученного результата. Участок ДНК выделяют при помощи электрофореза при добавлении бромистого этидия. Когда он соединяется с ДНК, то образуются светящиеся полосочки. Образец анализируют в ультрафиолете. Если имеются светящиеся полосы оранжевой окраски, то получен положительный результат. При наличии современного анализатора ПЦР этапы по выделению ДНК, амплификации и определению возбудителя могут быть выполнены прибором в автоматизированном режиме. Участия человека при этом не требуется.
- Интерпретация результатов. Положительный итог исследования говорит о присутствии инфекции. Количественная оценка может показать степень тяжести заболевания.

Наполнение пробирок образцами крови
Цена на проведение процедуры
Стоимость ПЦР определяется тем, какую инфекцию будут исследовать. Также она зависит от методики проводимого тестирования. Средняя цена анализа находится в пределах от 200 до 850 руб. В стоимость входит и плата за забор материала — около 400 руб.
Ориентировочные цены на исследование ПЦР.
| Исследуемая инфекция | Цена, руб |
| ВПЧ | 360-1920 |
| Хламидия | 800 |
| Краснуха | 830 |
| Микоплазма хоминис | 560 |
| Кандида | 590 |
| Микоплазма гениталиум | 370 |
| Герпес | 360-610 |
| Гонококк | 370 |
| Уреплазма | 360 |
Зачастую медицинские учреждения предлагают провести анализ одновременно на несколько инфекций, чтобы выявить нужную. Такое обследование будет стоить дороже, но оно избавит от необходимости дополнительных исследований, что сэкономит время пациента.
ПЦР-диагностика внутриутробных инфекций
Во время беременности лабораторная диагностика инфекций приобретает особое значение, так как существует опасность заражения инфекцией плода. Анализы на цитомегаловирус, токсоплазмы, вирус герпеса, вирус краснухи, микоплазмы и хламидии образуют так называемый TORCH-комплекс , обязательный этап пренатальной диагностики для каждой женщины. Для проведения анализа в качестве материала используется амниотическая жидкость или ворсинки хориона.
Диагностика внутриутробных инфекций у новорожденного ребенка стала возможной только благодаря методам ПЦР-анализа. Серодиагностика (РИФ, ПИФ, ИФА-анализы) малоэффективна для определения инфекций, поскольку основана на выявлении антител ДНК к инфекциям, а формирование иммунной системы у новорожденного начинается только спустя несколько месяцев после рождения. В этот период организм ребенка может или вообще не вырабатывать антитела, или «принимать» материнские антитела класса IgG, проникающие к ребенку через плаценту еще во время беременности.
Конъюнктивит, пневмония и многие другие серьезные заболевания у малыша могут возникнуть вследствие поражения хламидиями, микоплазмой. Для того чтобы выявить причину этих заболеваний с помощью ПЦР-анализа у ребенка исследуется эпителиальный соскоб с конъюнктивы или задний стенки глотки, кроме того, материалом для диагностики может служить моча или слюна.
ПЦР-диагностика нашла свое применение и в других областях клинической медицины. В гастроэнтерологии метод ПЦР-анализа — ведущий метод диагностики геликобактериоза. Геликобактер — возбудитель этого заболевания живет в кислой среде желудка и при определенных условиях провоцирует развитие язвенной болезни.
В пульмонологии методы ДНК-анализа используются для диагностики рецидивирующих респираторных заболеваний, атипичной пневмонии, хронического бронхита, туберкулеза, поскольку частой причиной этих болезней являются микоплазмы и хламидии.
Большинство заболеваний, которые Вы можете диагностировать методом ПЦР-диагностики в нашем медицинском центре «Евромедпрестиж», отражены в ниже:
|
Цервицит Эндометрит Бактериальный вагиноз |
Цервикальный соскоб аспират из полости матки |
|
Вагинит Вульвовагинит |
Эпителиальный соскоб из влагалища |
|
Уретрит Простатит |
Соскоб из уретры Моча Сок простаты |
| Эпидидимит | Сперма |
| Проктит | Соскоб из прямой кишки |
|
Бесплодие Невынашивание беременности Эктопическая беременность |
Цервикальный соскоб |
| Синдром Рейтера | Эпителиальный соскоб из уретры Эпителиальный соскоб из конъюнктивы |
| Герпетические поражения гениталий, слизистых оболочек, кожных покровов и др | Эпителиальный соскоб с пораженного участка Кровь |
| Кандиломатоз | Эпителиальный соскоб с пораженного участка |
| Рецидивирующие хронические заболевания верхних отделов дыхательной системы | Эпителиальный соскоб с задней стенки глотки Бронхоальвеолярный лаваж Мокрота |
| Цитомегаловирусная инфекция | Кровь Моча Слюна |
| Внутриутробная цитомегаловирусная инфекция | Амниотическая жидкость Биоптаты |
| Туберкулез легких | Мокрота Бронхоальвеолярный лаваж |
| Туберкулез мочеполовых и др. органов | Моча Соскоб с пораженного участка |
|
Язва желудка Гастрит Дуоденит |
Биоптат слизистой |
| Вирусный гепатит | Кровь Биоптаты печени |
Классификация используемых флуорофоров[править | править код]
Специфическая детекция: флуоресцентный репортерный зондправить | править код
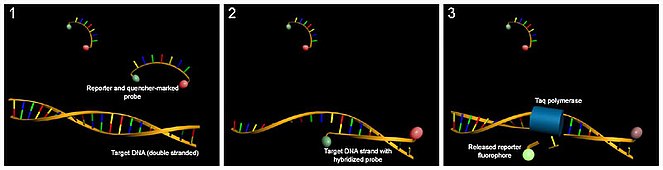
кПЦР с использованием флуоресцентного зонда
Флуоресцентные репортерные зонды обнаруживают только ДНК-содержащую последовательность, комплементарную зонду; следовательно, использование репортерного зонда значительно повышает специфичность и позволяет повысить точность измерения в присутствии других дцДНК. Однако флуоресцентные репортерные зонды не предотвращают ингибирующий эффект димеров праймера, которые могут подавлять накопление целевых продуктов реакции.
Можно также использовать несколько зондов, у которых флуорофоры имеют разные спектры испускания. В таком случае появляется возможность в одной пробирке детектировать сигнал от разных молекул ДНК. Метод носит название множественной ПЦР (англ. multiplex PCR).
Метод основан на введении комплементарного продукту амплификации ДНК-зонда с флуоресцентным репортером на одном конце зонда и гасителем флуоресценции на противоположном. Когда гаситель находится в непосредственной близости от репортера, он поглощает сигнал и репортер не даёт флуоресценции. Во время амплификации целостность зонда нарушается и репортер можно обнаружить по флуоресценции после возбуждения лазером. Следовательно, увеличение количества продукта, с которым связывается репортерный зонд в каждом цикле ПЦР, вызывает пропорциональное увеличение флуоресценции. Метки могут давать флуоресценцию в фазу элонгации или в фазу отжига ПЦР.
Метки, работающие в фазу элонгации:
На зонд с 5’ и 3’ концов пришиты флуорофор и его гаситель. Если последовательность зонда не очень длинная, то даже в связанном с ДНК состоянии они будут взаимодействовать друг с другом, и не будет испускаться флуоресценция. Во время элонгации ДНК-полимераза, обладающая 5’-3’-экзонуклеазной активностью (часто используется Taq-полимераза), по одному нуклеотиду диссоциирует зонд от ДНК-мишени. В результате этого процесса и флуорофор, и его гаситель попадут в раствор, где вероятность нахождения этих веществ рядом будет небольшой, и флуоресценция восстановится.
Метки, работающие в фазу отжига:
- Флуорогенная шпилька — небольшая одноцепочечная молекула ДНК, которая в свободном состоянии способна образовывать особую пространственную структуру ДНК — шпильку. На один конец цепочки пришивают флуорофор, а на второй — вещество, его гасящее. Последовательность зонда комплементарна ДНК-мишени, которую нужно детектировать. В таком случае те молекулы зонда, которые плавают в растворе, не будут давать флуоресцентный сигнал, а связавшиеся с молекулами ДНК будут претерпевать конформационные изменения, в результате которых произойдет пространственное разнесение флуорофора и его гасителя и восстановление флуоресценции. Детекцию целесообразно проводить после денатурации.
- Метка, основанная на методе FRET. Основа этого метода — наличие двух зондов, которые связываются с ДНК-мишенью на небольшом расстоянии друг от друга. На 5’-конец одного зонда и 3’-конец второго пришиты флуорофор-донор и флуорофор-акцептор соответственно. При их близком расположении происходит следующее: флуорофор-донор поглощает свет определённой длины волны и испускает свечение в более длинноволновом спектре. Эту волну, в свою очередь, поглощает флуорофор-акцептор и испускает свет, который можно детектировать.
Какие преимущества имеет данная диагностика?
- Универсальность: для этого метода подходят любые образцы нуклеиновой кислоты.
- Высокая специфичность: возбудитель имеет уникальные последовательности цепочек ДНК, которые свойственны именно ему. Поэтому результаты проведённой ПЦР будут достоверными, в них невозможно спутать ген одного возбудителя с геном другого возбудителя.
- Чувствительность к наличию даже единичной молекулы возбудителя.
- Маленький объем материала, нужного для исследования. Подойдет даже капля крови. Возможность получить результат, использовав минимальный объём пробы, очень важна для педиатрических, неонатологических, неврологических исследований, а также в практике судебной медицины.
- Возможность определения вялотекущей, хронической инфекции, а не только острой.
- Многие болезнетворные культуры очень сложно культивировать в пробирке другими методиками, а полимеразная реакция позволяет размножить культуру в нужном количестве.
Ход анализа полимеразной цепной реакции
Анализ ПЦР происходит в 4 основных этапа:
- подготовка материала к копированию;
- объединение фрагмента ДНК и праймера;
- копирование генетического набора исследуемого материала;
- идентификация и оценка полученного ДНК-набора.
Этап 1
Образец подогревают до температуры 94-98°C в специальном приборе — амплификаторе, который программируется на выдерживание точных температур с низкой погрешностью. Заданная температура держится на протяжении минуты-двух. Это необходимо для денатурации ДНК, чтобы двойная спираль разошлась на две отдельные цепочки.
Этап 2
Температура в амплификаторе понижается до 72-75°C для того, чтобы праймер смог распознать сходный с ним участок ДНК-цепи и объединиться с ним.
Праймеры — это специальные реагенты, которые подходят только к одному виду возбудителя. Если необходимо провести анализ на несколько патогенов, то в образец добавляют необходимое количество праймеров.
На этой стадии ДНК реплицирует свою матрицу, используя праймер.
Возможности лаборатории ограничены наличием праймеров для определенных микроорганизмов, поэтому диапазон возможностей определяется наличием таких образцов.
Этап 3
В этом отрезке происходит увеличение генетического материала возбудителя. К праймеру с матрицей приближается фермент и воспроизводит новую цепь ДНК, идентичную той, которая содержалась в первоначальной цепочке.
Когда синтез окончен, завершается один полный цикл полимеразной цепной реакции. По времени он продолжается в среднем до 3 минут. За это время происходит удваивание материала. Дальнейшее увеличение количества цепочек происходит в геометрической прогрессии, и к окончанию анализа успевает пройти 50-80 циклов.
Этап 4
Этап, требующий внимательности и особой тщательности со стороны персонала.
Определение микроорганизма происходит с использованием электрофореза или меток, наносимых окраской. При использовании электрофореза определяющим моментом становится длина фрагментов ДНК, а при использовании меток — развитие окраски в ходе ферментативной реакции.
Примечания
- Mullis, Kary B. et al. «Process for amplifying, detecting, and/or-cloning nucleic acid sequences»
- Saiki R.K., Scharf S., Faloona F., Mullis K.B., Horn G.T., Erlich H.A., Arnheim N. Science 1985 Dec 20; 230 (4732): 1350-4; Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia.
- Каледин А. С., Слюсаренко А. Г., Городецкий С. И. // Биохимия. — 1980. — T. 45. — C. 644—651.
- Alice Chien, David B. Edgar и John M. Trela. Deoxyribonucleic Acid Polymerase from Extreme Thermophilic Thermus aquaticus. Jourmal of Bacteriology, Sept. 1976, pp. 1550—1557.
-
(недоступная ссылка). Дата обращения 29 августа 2007.
- 1 kbp (kilo base pair (англ.)) — 1 тысяча пар оснований, единица измерения длины ДНК
-
(недоступная ссылка). Дата обращения 1 сентября 2007.
- Отжиг (англ. annealing) — гибридизация фрагментов ДНК
- Шпилька — внутримолекулярная самокомплементарная структура
- Димер — межмолекулярные структуры, образуемые праймерами друг с другом или сами с собой
-
. Дата обращения 30 октября 2012.
- United States Patent 7,972,820. July 5, 2011. Isothermal amplification of nucleic acids on a solid support