Сульфат алюминия
Содержание:
- Эффективность
- Способы применения
- Описание
- Аналоги гидроксида алюминия
- Показания к применению
- Гидроксид алюминия
- Основные свойства вещества
- Инструкция по применению гидроксида алюминия
- Получение гидроксида алюминия
- Особые указания
- Полезные свойства
- Алюминия гидроксид (Aluminium hydroxide)
- Химические свойства
- Глинозем
- Химическое название
Эффективность
Подобный эксперимент возможно провести в домашних условиях.
Для этого понадобится:
- хорошо проветриваемое помещение;
- реагенты;
- дистиллированная вода;
- металлическая посуда;
- перчатки;
- защитные очки;
- стеклянные колбы.
Основной задачей выведения данного состава является нейтрализации кислых продуктов разложения полимеров и снижения токсичности испарения. Образуемая в процессе горения вода способствует разбавлению газов, которые вырабатываются в процессе горения. Она значительно снижает дымовыделение и токсичность испарений.
Активное употребление данного соединения практикуется в косметологии, медицине, пищевой и технологической промышленности. Этот компонент является абсолютно безвредным для человека только тогда, когда он производится с учетом всех технологических процессов.
Способы применения
Существует несколько методик для получения чистого гидроксида алюминия. Основой для образования осадка выступает бокситовая руда с высоким содержанием оксида металла.
Домашние рецепты
Гидроксид алюминия используют в качестве загустителя и вяжущего вещества. С добавлением того элемента можно приготовить полезные косметические средства в домашних условиях.
1. Зубная паста на основе прополиса:
- белая глина — 60 г;
- мед – 1 ч.л.;
- вода;
- гидроксид алюминия — 1 г;
- эфирное масло шалфея или ромашки.

Способ приготовления:
- В белую глину капнуть 5-7 капель эфирного масла.
- В ложку меда отдельно добавить масло.
- Смешать две субстанции и добавить гидроксид алюминия до загустения основы. Количество оксида натрия может изменяться в зависимости от консистенции.
2. Огуречный увлажняющий крем:
- воск — 10 г;
- миндальное масло — 40 мл;
- гидроксид алюминия (по состоянию);
- мякоть огурца;
- вода.
Способ приготовления:
- Смешать воск и миндальное масло.
- На водяной бане нагреть и перемешать все ингредиенты.
- В теплую смесь добавить мякоть огурца и очищенную воду (40 мл).
- Тщательно размешать и добавить оксид алюминия.
- Полученную смесь необходимо поставить на огонь в течении 30 мин., периодически помешивать.
- После полного охлаждения хранить в холодильнике.
3. Антицеллюлитный крем.
Ингредиенты:
- детский крем;
- эфирное масло апельсина;
- таблетки мумие 5-6 шт.;
- гидроксид алюминия (по применению).

Способ приготовления:
- Раздавить таблетки мумие в крошку.
- Смешать все ингредиенты.
- Нагреть до полного растворения.
- Добавить оксид алюминия по мере загустения.
- Охладить.
- Закрыть плотной крышкой.
Описание
Гидроксид алюминия, в основном, используют для получения чистого алюминия или хлорида алюминия в промышленных целях. В природе чаще всего встречается в виде корунда, различных минералов. Его, чаще всего, используют в качестве абсорбента, катализатора или подсушивающей основы.
Особенности
Является ключевым материалом в производстве огнеупорного и зубного цемента. В чистом и сухом виде данный элемент выглядит как белый порошок или гранулы, которые не растворяются в воде.
Растворить гидроксид алюминия можно только в сильных растворах кислот или щелочи. Он выступает катализаторам для образования новых соединений, но не вступает в реакцию практически ни с одним другим элементом.
Чаще всего гидроксид алюминия можно встретить в сухом состоянии, в виде порошка.
Благодаря своим способностям абсорбировать вещества используются в медицинских целях. Состав не пропускает электричество, задерживает тепло, подавляет горение материалов. Главным свойством элемента является адсорбция горючих газов.
Основным способом получения сухого гидроксида алюминия является метод Байера. Его техника заключается в гидролизе алюминатного раствора с дальнейшим образованием гидроксида алюминия в форме кристаллов или осадка. Такой метод относится к гидрохимическим щелочным процессам.
Также гидроксид алюминия можно встретить и в жидком состоянии. Оно характеризуется желеобразным видом. Данная субстанция плохо растворяется в воде и менее востребована в промышленном использовании.
Получение
Получить гидроксид алюминия можно 2 способами.
Они отличаются в зависимости от того, какое состояние элемента необходимо образовать в конце реакции:
- Для того чтобы получить жидкий состав, необходимо воспользоваться химической реакцией обмена, используя водный раствор аммиака и хлоридную соль алюминия. В конце реакции получается желеобразное вещество.
- Гидроксид алюминия химические свойства в сухом виде имеет другие, поэтому кристаллическое или твердое состояние получить сложнее. Для этого в домашних условиях понадобится специализированное оборудование и реагенты. Сам процесс довольно простой. В предварительно растворенную щелочь тетрагидроксодиакваалюмината натрия пропускают диоксид углерода.
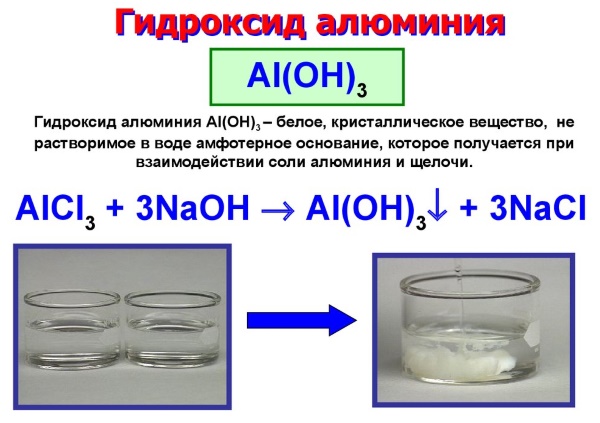
Процесс получения гидроксида алюминия достаточно токсичен для человека и может быть возбудителем различных аллергических реакций. При работе с подобного рода веществами необходимо помнить об использовании специальных перчаток и защитных очков.
Химический состав
В жидком составе гидроксид алюминия химически активнее и быстрее растворяется в кислотных растворах и щелочи. Его молярная масса равна 78 моль. В соединениях с другими элементами гидроксид алюминия выступает связующим звеном в реакции.
В основном, данную реакцию используют для очистки воды от различных примесей. Вступая в реакцию, добавки образуют осадок, который легко отфильтровывается из жидкости или раствора.
Одной из положительных характеристик данного соединения является проявления кислотных и щелочных свойств при различных условиях:
- Когда в реакции гидроксид алюминия выступает как щелочь, то на выходе образуется соль, которая заряжена положительными катионами.
- Если же в реакции гидроксид алюминия выступает как кислота, то конечным результатом будет соль с металлом, негативно заряженными анионами.
Такая двойственность данного соединения открывает широкий спектр использования не только в промышленности, но и медицине, косметологии, обработке.
Данное химическое соединение позволяет отфильтровывать из воды или жидкостей большое количество вредных веществ. В медицинском производстве используется как абсорбирующее соединение, которое позволяет вывести из организма вещества, раздражающие стенки желудка.
Аналоги гидроксида алюминия
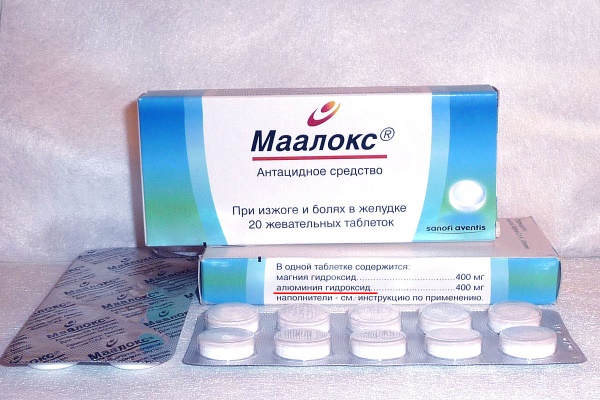
Аналогами гидроксида алюминия, содержащими в качестве активного вещества алгелдрат, являются следующие препараты:
- Аджифлюкс – таблетки;
- Алмагель, Алмагель А и Алмагель Нео – суспензия;
- Алтацид – суспензия и таблетки жевательные;
- Алюмаг – таблетки;
- Гастрацид – таблетки;
- Маалокс и Маалокс мини – таблетки и суспензия;
- Палмагель – гель для приема внутрь;
- Сималгел ВМ – суспензия для приема внутрь.
Аналогами гидроксида алюминия из группы антацидных препаратов являются следующие:
- Гастал таблетки;
- Гевискон, Гевискон форте и Гевискон двойное действие таблетки и суспензия;
- Иналан таблетки;
- Палмагель А гель для приема внутрь;
- Ренни таблетки;
- Гастроромазол экстракт для приема внутрь;
- Фосфалюгель гель для приема внутрь.
Показания к применению
- Эзофагит;
- Рефлюкс-эзофагит;
- Острый гастрит;
- Хронический гастрит с повышенной кислотностью желудочного сока;
- Острый дуоденит;
- Язвенная болезнь желудка или двенадцатиперстной кишки в период обострения;
- Симптоматические язвы или эрозии на слизистых оболочках органов пищеварительного тракта;
- Грыжа пищеводного отверстия диафрагмы;
- Острый панкреатит;
- Гиперфосфатемия (повышенный уровень фосфатов в крови);
- Функциональные расстройства работы кишечника (например, синдром раздраженного кишечника и др.);
- Колиты;
- Симптомы диспепсии при заболевания желудка или кишечника (например, ощущение дискомфорта, тяжести и боли в желудке, изжога, отрыжка кислым и т. д.);
- Симптомы диспепсии (например, ощущение дискомфорта, тяжести и боли в желудке, изжога, отрыжка кислым и т. д.), возникающие после погрешностей в диете, употребления алкоголя, курения, кофе и т. д.
Гидроксид алюминия
Al2 (OH)3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Основные свойства вещества
Физические свойства гидроксида алюминия: плотность — 2,423 грамм на сантиметр кубический, уровень растворяемости в воде — низкий, цвет — белый либо прозрачный. Вещество может существовать в четырех полиморфных вариантах. Под воздействием низких температур образуется альфа-гидроксид, называемый байеритом. Под воздействие нагревания можно получить гамма-гидроксид или гиббсит. Оба вещества имеют кристаллическую молекулярную решетку с водородными межмолекулярными типами связи. Также встречаются еще две модификации — бета-гидроксид или нордстандрит и триклинный гибсит. Первая получается путем прокаливания байерита или гиббсита.Второй отличается от остальных видов триклинным, а не монообразным строением кристаллической решетки.
Химические свойства гидроксида алюминия: молярная масса — 78 моль, в жидком состоянии хорошо растворяется в активных кислотах и щелочах, при нагревании разлагается, обладает амфотерными признаками. В промышленности в подавляющем большинстве случаев используется именно жидкий гидроксид, так как благодаря высокому уровню химической активности, он легко поддается обработки и не требует использования катализаторов или специальных условий протекания реакции.
Амфотерность гидроксида алюминия проявляется в двойственности его природы. Это означает, что в различных условиях он может проявлять кислотные либо щелочные свойства. Когда гидроксид принимает участие в реакции как щелочь, образуется соль, в которой алюминий является положительно заряженным катионом. Выступая в качестве кислоты, гидроксид алюминия на выходе также образует соль. Но в этом случае металл уже играет роль отрицательно заряженного аниона. Двойственная природа открывает широкие возможности по применению данного химического соединения. Оно используется в медицине для изготовления лекарственных препаратов, назначаемых при нарушении кислотно-щелочного баланса в организме.
Гидроксид алюминия входит в состав вакцин в качестве вещества, усиливающего иммунную реакцию организма на раздражитель. Нерастворимость осадка гидроксида алюминия в воде позволяет использовать вещество в водоочистных целях. Химическое соединение является очень сильным адсорбентом, который позволяет извлекать из состава воды большое количество вредных элементов.
Инструкция по применению гидроксида алюминия
Правила применения суспензии гидроксида алюминия
желудкакишечникаязвенной болезни желудкаизжогисимптомовдиспепсииболь в животепочечной недостаточностизапору
Передозировка
- Стойкий запор;
- Рвота;
- Боль в животе;
- Сужение просвета кишечника вплоть до формирования непроходимости;
- Гипофосфатемия (дефицит фосфора в крови);
- Энцефалопатия.
почкамимочегонные средстваФуросемидгемодиализ
Взаимодействие с другими лекарственными средствами
- Атенолол;
- Ацетилсалициловая кислота (Аспирин и др.);
- Бифосфонаты;
- Гистаминоблокаторы (Зиртек, Зодак, Кларитин, Эриус, Телфаст, Супрастин, Фенистил и т. д.);
- Глюкокортикостероиды (Преднизолон, Бетаметазон и Дексаметазон);
- Дигоксин;
- Дифлунисал;
- Изониазид;
- Индометацин;
- Кетоконазол;
- Лансопразол;
- Линкозамид;
- Левотироксин;
- Метопролол;
- Нейролептики (Галоперидол, Аминазин и др.);
- Пеницилламин;
- Полистиролсульфат натрия;
- Препараты железа (Фенюльс, Феррум Лек, Сорбифер и т. д.);
- Пропранолол;
- Розувастатин;
- Тетрациклиновые антибиотики (Тетрациклин, Доксициклин и др.);
- Фторхинолон;
- Фторид натрия;
- Фосфорсодержащие БАДы;
- Фексофенадин;
- Хлорохин;
- Цефдинир;
- Цефподоксим;
- Этамбутол.
Получение гидроксида алюминия
Получение гидроксида алюминия происходит благодаря химической реакции обмена. Для этого используют водный раствор аммиака и какую-либо соль алюминия, чаще всего хлорид алюминий. Таким образом получают жидкое вещество. Если необходим твердый гидроксид, через растворенную щелочь тетрагидроксодиакваалюмината натрия пропускают диоксид углерода. Многих любителей экспериментов волнует вопрос, как получить гидроксид алюминия в домашних условиях? Для этого достаточно приобрести в специализированном магазине необходимые реагенты и химическую посуду.
Для получения твердого вещества понадобится еще и специально оборудование, так что лучше остановиться на жидком варианте. При проведении реакции необходимо использовать хорошо проветриваемое помещение, так как одним из побочных продуктов может быть газ или вещество с резким запахом, который может негативно сказаться на самочувствии и здоровье человека. Работать стоит в специальных защитных перчатках, так как большинство кислот при попадании на кожу вызывают химические ожоги. Не лишним будет позаботиться и о защите для глаз в виде специальных очков. Приступая к любому делу, в первую очередь необходимо думать об обеспечении безопасности!
Свежесинтезированный гидроксид алюминия реагирует с большинством активных кислот и щелочей. Именно поэтому для его получения используют аммиачную воду, чтобы сохранить образованное вещество в чистом виде. При использовании для получения кислоты или щелочи необходимо максимально точно рассчитать пропорцию элементов, иначе при избытке полученный гидроксид алюминия взаимодействует с остатками непоглощенной основы и полностью растворяется в ней. Это происходит из-за высокого уровня химической активности алюминия и его соединений.
В основном, гидроксид алюминия получают из бокситовой руды с высоким содержанием оксида металла. Процедура позволяет быстро и относительно дешево отделить полезные элементы от пустой породы. Реакции гидроксида алюминия с кислотами приводят к восстановлению солей и образованию воды, а с щелочами — к получению комплексных гидрооксоалюминиевых солей. Твердый гидроксид методом сплавки соединяют с твердыми щелочами с образованием метаалюминатов.
Особые указания
Вещество не рекомендуется назначать детям.
Особую осторожность соблюдают при лечении пациентов с нарушениями фосфорного обмена. Нельзя превышать рекомендуемую суточную дозировку средства, это может привести к дефициту фосфора в организме, вызвать костную резорбцию и гиперкальциурию с остеомаляцией
Нельзя превышать рекомендуемую суточную дозировку средства, это может привести к дефициту фосфора в организме, вызвать костную резорбцию и гиперкальциурию с остеомаляцией.
Необходимо выдерживать 2-х часовой промежуток между приемом лекарства и индометацина, аминазина, салицилатов, фенитоина, бета-адреноблокаторов, изониазида, блокаторов гистаминовых Н2-рецепторов, дифлунизала, фосфоросодержащих препаратов.
Полезные свойства

Гидроксид алюминия входит в состав большинства дезодорантов, шампуней, скрабов и других изделий косметической промышленности
Его основные свойства заключается в вяжущих и абсорбирующих функциях. При использовании по назначению абсолютно безопасен для человека. Благодаря своим гипоаллергенным способностям стимулирует микроциркуляцию и регенерацию кожи.
Для женщин
Хоть гидрат алюминия является синтетическим компонентом, но он не обладает опасными свойствами для человека. Такой состав использует в косметической сфере для производства пудры, румян, разглаживающий баз под тональную основу, компактных пудрах, различных пигментов и красителях.
Гидроксид алюминия благодаря кристаллической структуре обладает отшелушивающими функциями и способствует восстановлению кожного покрова. Особенно активно его химические свойства используются для омолаживающей процедуры микродермабразии.
Процедура микродермабразии представляет собой алмазную шлифовку верхнего слоя кожи. Алмазной она называется потому, что наружный слой насадки покрыт амбразивным материалом — гидроксидом алюминия. Сам состав представляет собой пыль или крошку.

Процедура производится с помощью прибора с различными насадками разного размера, с алмазным напылением. Механическими движениями поверхность аппарата бережно шлифует верхний слой кожи, убирая омертвевшие клетки кожи. Данная процедура является щадящей и одной из самых популярных в косметической индустрии. Она борется с морщинами, сужает поры, разглаживает рубцы и шрамы.
Также окись гидрата алюминия используют для проведения косметических пилингов и скрабов. Подобные процедуры можно проводить только после консультации со специалистом и в специализированных клиниках. По заключению исследователей, использование по назначению продуктов, содержащих гидроксид алюминия при беременности или грудном вскармливании, никак не повлияет на развитие плода.
Для мужчин
Так как данное соединение является безопасным для организма человека, то его принято добавлять в косметические средства для личной гигиены.

Таким образом, встретить гидроксид алюминия можно в таких продуктах для мужчин:
- зубные пасты;
- лосьоны до и после бритья;
- дезодоранты;
- шампуни;
- кондиционеры.
Соединение абсолютно универсальное и используется для придания однородной консистенции продуктам по уходу за кожей.
Для детей
Гидроксид алюминия химические свойства имеет такие, что является вспомогательным компонентом в вакцинах, которые делаю детям в раннем возрасте. Именно тот элемент необходим, для того, чтобы усилить иммунный ответ у детей. Это характеризуется сильной связью антигенов с алюминием.
Благодаря гидрату алюминия наши собственные молекулы учатся самостоятельно бороться с инфекцией, которая попадает в наш организм. Алюминий имеет свойства накапливаться в нервных тканях. Последствиями становятся нарушение и расстройства нервной системы.
Довольно часто, современные мамочки отказываются от вакцинации. Но, для того, чтобы алюминий произвел токсичное вмешательство в развитие организма, его масса должна быть от 3,2-7,3 мг на 1 кг массы тела человека. Общая норма поступления гидроксида алюминия в тело ребенка составляет 0,55 мг на общую массу 5 кг ребенка.
Не стоит забывать, что оксид алюминия плохо растворяется в воде, а значит и в крови будет проявлять подобные характеристики.
Алюминия гидроксид (Aluminium hydroxide)
K25 Язва желудка
K26 Язва двенадцатиперстной кишки
K29 Гастрит и дуоденит
K29.6.1* Гастрит гиперацидный
K31.8.2* Гиперацидность желудочного сока
K86.8.3* Синдром Золлингера-Эллисона
Аморфный рыхлый белый порошок. Практически нерастворим в воде (образует гель). Растворим при нагревании в разбавленных кислотах и растворах едких щелочей.
Нейтрализует соляную кислоту желудка с образованием хлорида алюминия и воды. pH желудочного сока постепенно повышается до 3,4–4,4 и остается на этом уровне в течение нескольких часов, что сопровождается снижением протеолитической активности желудочного сока. В щелочном содержимом кишечника образует нерастворимые соединения алюминия. Даже при длительном лечении не отмечается развития алкалоза.
Гиперацидность желудочного сока, гиперацидный гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, дуоденит.
Запор (при длительном применении).
Окись магния усиливает антацидный эффект, снижая вероятность запоров.
Внутрь.
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
кислотами
- Al(OH)3+3HCl⟶AlCl3+3H2O{\displaystyle {\mathsf {Al(OH)_{3}+3HCl\longrightarrow AlCl_{3}+3H_{2}O}}}
- Al(OH)3+3HNO3⟶Al(NO3)3+3H2O{\displaystyle {\ce {Al(OH)3 +3HNO3 -> Al(NO3)3 + 3H2O}}}
щелочами
- В концентрированном растворе гидроксида натрия:
- Al(OH)3+NaOH⟶NaAl(OH)4{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\longrightarrow Na}}}
- При сплавлении твёрдых реагентов:
- Al(OH)3+NaOH →1000oC NaAlO2+2H2O{\displaystyle {\mathsf {Al(OH)_{3}+NaOH\ {\xrightarrow {1000^{o}C}}\ NaAlO_{2}+2H_{2}O}}}
При нагревании разлагается:
-
- 2Al(OH)3 →t>575oC Al2O3+3H2O{\displaystyle {\mathsf {2Al(OH)_{3}\ {\xrightarrow {t>575^{o}C}}\ Al_{2}O_{3}+3H_{2}O}}}
С растворами аммиака не реагирует.
Глинозем
Полученный оксид алюминия имеет геологическое название глинозем. В естественных условиях он встречается в виде корунда – твердых прозрачных кристаллов. Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Физические свойства оксида алюминия позволяют выращивать эти драгоценные камни в искусственных условиях. Технические драгоценные камни используются не только для ювелирных украшений, они применяются в точном приборостроении, для изготовления часов и прочего. Широко используются искусственные кристаллы рубина и в лазерных устройствах.
Мелкозернистая разновидность корунда с большим количеством примесей, нанесенная на специальную поверхность, известна всем как наждак. Физические свойства оксида алюминия объясняют высокие абразивные свойства корунда, а также его твердость и устойчивость к трению.
Химическое название
Гидроокись алюминия
Химическая формула Гидроксида Алюминия: Al(OH)3. Это химическое соединение оксида алюминия с водой. Синтезируют в виде белого желеобразного вещества, которое плохо растворимо в воде. У гидроксида имеются 4 кристаллические модификации: нордстрандит (β), моноклинный (γ) гиббсит, байерит (γ) и гидрагилит. Также существует аморфное вещество, состав которого варьируется: Al2O3•nH2O.
Химические свойства. Соединение проявляет амфотерные свойства. Гидроксид Алюминия реагирует с щелочами: при реакции с гидроксидом натрия в растворе получается Na(Al(OH)4); при сплавлении веществ образуется вода и NaAlO2.При нагревании наблюдается разложение Гидроксида Алюминия до воды и оксида алюминия. Вещество не реагирует с раствором аммиака. Реакция алюминий плюс гидроксид натрия: 2Al + 2NaOH + 6H2O = 2Na + 3H2.
Получение Гидроксида Алюминия. Химическое соединение получают из солей Al при их взаимодействии с водным раствором щелочи в недостатке, избегая избытка. К хлориду алюминия AlCl3 прибавляют натрия гидроксид – в результате требуемое вещество выпадает в виде белого осадка и дополнительно образуется хлорид натрия.
Также средство можно получить с помощью реакции водорастворимой соли алюминия с карбонатом щелочного металла. Например, к хлориду алюминия прибавить карбонат натрия и воду – в результате получим хлорид натрия, углекислый газ и гидроксид Al.
Применение:
- используют для очистки воды в качестве адсорбента;
- можно синтезировать сульфат алюминия при взаимодействии гидроксида Al и серной кислоты;
- в качестве адъюванта при изготовлении вакцины;
- в медицине в виде антацида;
- при изготовлении пластика и прочих материалов в виде подавителя процессов горения.